题目内容
7.常温下,柠檬水溶液的pH是3,其中的c(OH-)是( )| A. | 10-11mol/L | B. | 10-3mol/L | C. | 10-7mol/L | D. | 0.1 mol/L |
分析 根据Kw=c(OH-)×c(H+)=1×10-14以及pH=-lg[c(H+)]计算.
解答 解:柠檬水溶液的pH=3,则c(H+)=1×10-3mol/L,
因Kw=c(OH-)×c(H+)=1×10-14,
则c(OH-)=1×10-11mol•L-1,
故选A.
点评 本题考查pH的简单计算,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
相关题目
20.下列反应中,二氧化碳作氧化剂的是( )
| A. | Ca(OH)2+CO2═CaCO3↓+H2O | B. | 2Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2 | ||
| C. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO | D. | CO2+H2O═H2CO3 |
18.下列氯化物中,能直接利用金属与稀盐酸的反应得到的是( )
| A. | FeCl3 | B. | CuCl2 | C. | AgCl | D. | FeCl2 |
15.容量瓶上需要标有:①温度,②浓度,③容量,④压强,⑤刻度线,⑥碱式或酸式六项中的( )
| A. | ①③⑤ | B. | ②④⑥ | C. | ③⑤⑥ | D. | ①②③ |
12.下列说说法中,正确的是( )
| A. | 非金属性最强的元素,其最高价氧化物对应水化物的酸性最强 | |
| B. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| C. | 同一主族元素的氢化物,相对分子质贤越大,它的沸点一定越高 | |
| D. | 在周期表中,主族序数都等于该族元素的最外层电子数 |
19.下列说法或表达正确的是( )
①次氯酸的电子式为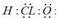
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④NaHSO4在溶于水时能电离出Na+、SO42-、H+
⑤将金属a与电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀.
①次氯酸的电子式为
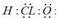
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④NaHSO4在溶于水时能电离出Na+、SO42-、H+
⑤将金属a与电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀.
| A. | ①③⑤ | B. | ①②③ | C. | ④⑤ | D. | ②④ |
16.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如表所示:
由此判断:
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,
溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-;
溶液中可能存在的离子是K+、Cl-.
(2)请设计实验验证原溶液中可能存在的阴离子的方法(写明操作、现象、结论)
取少许原溶液于试管中,先加入过量的硝酸钡溶液,再往上层清液中滴加硝酸银溶液,若出现白色沉淀则说明含有Cl-.
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,
溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-;
溶液中可能存在的离子是K+、Cl-.
(2)请设计实验验证原溶液中可能存在的阴离子的方法(写明操作、现象、结论)
取少许原溶液于试管中,先加入过量的硝酸钡溶液,再往上层清液中滴加硝酸银溶液,若出现白色沉淀则说明含有Cl-.
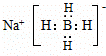 .
.