题目内容
2.用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )| A. | 16g氧气中所含的氧原子数为NA | |
| B. | 1molCl2与足量H2O反应,转移的电子数为2NA | |
| C. | 标准状况下,22.4L二氧化硅所含有的原子数目为3NA | |
| D. | 钠在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为4NA |
分析 A、氧气分子由氧原子构成;
B、氯气和水的反应为可逆反应;
C、标况下二氧化硅为固体;
D、氧气和钠反应后变为-1价.
解答 解:A、氧气分子由氧原子构成,故16g氧气中含有的氧原子的物质的量为n=$\frac{16g}{16g/mol}$=1mol,个数为NA个,故A正确;
B、氯气和水的反应为可逆反应,不能进行彻底,且反应为歧化反应,故转移的电子数小于NA个,故B错误;
C、标况下二氧化硅为固体,故不能根据气体摩尔体积来计算其物质的量和原子个数,故C错误;
D、氧气和钠反应后变为-1价,故1mol氧气得到2mol电子即2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
12.在农业上,尿素CO(NH2)2、NH4NO3、NH4HCO3、(NH4)2CO3都可以做氮肥使用.在这四种物质中,氮的质量分数最高的是( )
| A. | 尿素CO(NH2)2 | B. | NH4NO3 | C. | NH4HCO3 | D. | (NH4)2CO3 |
17.下列化学用语书写不正确的是( )
| A. | 氯离子的结构示意图: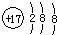 | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_6^{14}$C | |
| C. | 氯化镁的电子式: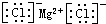 | |
| D. | 乙烯结构简式CH2=CH2 |
14.用已知物质的量浓度的NaOH溶液滴定未知物质的量浓度的盐酸,无论是酸往碱中滴还是碱往酸中滴,在其它操作正确规范的前提下,下列操作一定会使测定结果偏高的是( )
| A. | 酸式滴定管未用待测盐酸润洗 | |
| B. | 碱式滴定管未用标准碱液润洗 | |
| C. | 锥形瓶用蒸馏水洗净后未用待测液润洗 | |
| D. | 滴定前仰视读数,滴定后平视读数 |
11.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,能表示甲醇燃烧热的热化学方程式是( )
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.8kJ•mol-1 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1 | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1452kJ•mol-1 |
12.下表是某食用碘盐包装袋上的部分说明:
(1)下列说法正确的是A
A.高温会导致碘的损失 B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾 D.该碘盐中碘酸钾含量为20~50mg/kg
(2)碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI+3H2O $\frac{\underline{\;电解\;}}{\;}$KIO3+3H2↑.则阳极电极反应式为I --6e-+3H2O=IO3-+6H+
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并标出电子转移的方向和数目KIO3+KI+H2SO4=K2SO4+I2+H2O,该反应的氧化剂为KIO3
(4)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解 b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全 c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.则所测盐中碘的含量是$\frac{423}{w}$(以含w的代数式表示)mg/kg.
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
A.高温会导致碘的损失 B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾 D.该碘盐中碘酸钾含量为20~50mg/kg
(2)碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI+3H2O $\frac{\underline{\;电解\;}}{\;}$KIO3+3H2↑.则阳极电极反应式为I --6e-+3H2O=IO3-+6H+
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并标出电子转移的方向和数目KIO3+KI+H2SO4=K2SO4+I2+H2O,该反应的氧化剂为KIO3
(4)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解 b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全 c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.则所测盐中碘的含量是$\frac{423}{w}$(以含w的代数式表示)mg/kg.
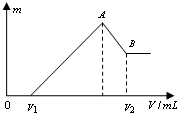 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
