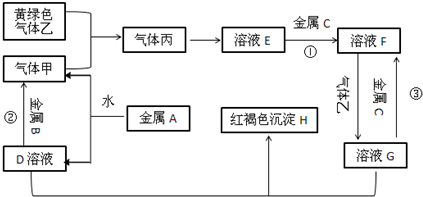
题目内容
17.下列化学用语书写不正确的是( )| A. | 氯离子的结构示意图: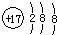 | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_6^{14}$C | |
| C. | 氯化镁的电子式: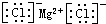 | |
| D. | 乙烯结构简式CH2=CH2 |
分析 A.氯离子的核电荷数为17;
B.作为相对原子质量测定标准的碳核素为C-12;
C.氯化镁属于离子化合物,其电子式需要标出所带电荷,氯离子还需要标出最外层电子;
D.碳碳双键不能省略.
解答 解:A.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构,氯离子正确的结构示意图为: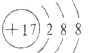 ,故A正确;
,故A正确;
B.C-12是作为相对原子质量测定标准的碳核素,正确表示方法为:612C,故B错误;
C.氯化镁为离子化合物,镁离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,氯化镁正确的电子式为: ,故C正确;
,故C正确;
D.碳碳双键不能省略,乙烯结构简式CH2=CH2,故D正确;
故选B.
点评 本题考查了元素符号、离子结构示意图、电子式等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及表示方法,明确离子化合物与共价化合物电子式的区别,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.为了除去粗盐中的 Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,其中正确的操作顺序是( )
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量 BaCl2溶液.
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量 BaCl2溶液.
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②④⑤①③ | D. | ⑤②④①③ |
5.下列叙述不正确的是( )
| A. | 硅酸钠溶液容易吸收空气中CO2变质而生成硅酸 | |
| B. | Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS | |
| C. | 实验室盛放NaOH溶液时不能使用玻璃塞,应该用橡胶塞 | |
| D. | 加碘食盐能使淀粉溶液变蓝 |
2.用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 16g氧气中所含的氧原子数为NA | |
| B. | 1molCl2与足量H2O反应,转移的电子数为2NA | |
| C. | 标准状况下,22.4L二氧化硅所含有的原子数目为3NA | |
| D. | 钠在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为4NA |
6.常用补钙片的有效成分是CaCO3,某化学探究小组欲测定某补钙片中碳酸钙的含量.查阅资料得知:
一种常用的分析试剂 EDTA二钠盐(用Na2H2Y•2H2O表示)可用于测定Ca2+,其反应为:Ca2++H2Y2-═CaY2-+2H+,以铬黑T为指示剂,滴定终点溶液由红色变为蓝色.于是该实验小组做了如下实验:
步骤一:配制待测溶液.取适量补钙片研碎后,准确称取0.400g配成250mL溶液.
步骤二:滴定.用移液管取待测液25.00mL于锥形瓶中,加入适量NaOH溶液,摇匀,再加入铬黑T指示剂3滴,用0.0100mol•L-1 EDTA二钠盐溶液滴定至终点.三次重复滴定平均消耗EDTA二钠盐溶液22.50mL.
请回答下列问题:
(1)步骤一中补钙剂要用2mol/L的盐酸溶解,反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,配制待测溶液所必需的仪器除研钵、药匙、分析天平、称量瓶、烧杯、玻璃棒外,还有250mL容量瓶、胶头滴管,操作的先后顺序为:e→b→a→d→f→g→h→c(填下列操作的序号).
A.盐酸溶解 b.称量 c.定容摇匀 d.加蒸馏水稀释 e.研磨
f.用NaOH溶液调节溶液pH至7 g.转移溶液 h.洗涤并转移
(2)实验测得补钙片中CaCO3的含量为56.3%.
(3)下列操作会导致测定结果偏高的是CDE(填下列选项的字母序号).
A.未将洗涤烧杯内壁的溶液转入容量瓶
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.定容时俯视刻度线
D.滴定管下端尖嘴中有气泡存在,滴定后气泡消失
E.滴定管用蒸馏水洗净后未用标准液润洗.
| 浓度/mol•L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 1.0 | 2.0 | 0 |
| 2 | 0.8 | 0.2 | |
| 4 | 1.0 | 0.5 | |
| 6 | 1.0 | 0.5 |
步骤一:配制待测溶液.取适量补钙片研碎后,准确称取0.400g配成250mL溶液.
步骤二:滴定.用移液管取待测液25.00mL于锥形瓶中,加入适量NaOH溶液,摇匀,再加入铬黑T指示剂3滴,用0.0100mol•L-1 EDTA二钠盐溶液滴定至终点.三次重复滴定平均消耗EDTA二钠盐溶液22.50mL.
请回答下列问题:
(1)步骤一中补钙剂要用2mol/L的盐酸溶解,反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,配制待测溶液所必需的仪器除研钵、药匙、分析天平、称量瓶、烧杯、玻璃棒外,还有250mL容量瓶、胶头滴管,操作的先后顺序为:e→b→a→d→f→g→h→c(填下列操作的序号).
A.盐酸溶解 b.称量 c.定容摇匀 d.加蒸馏水稀释 e.研磨
f.用NaOH溶液调节溶液pH至7 g.转移溶液 h.洗涤并转移
(2)实验测得补钙片中CaCO3的含量为56.3%.
(3)下列操作会导致测定结果偏高的是CDE(填下列选项的字母序号).
A.未将洗涤烧杯内壁的溶液转入容量瓶
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.定容时俯视刻度线
D.滴定管下端尖嘴中有气泡存在,滴定后气泡消失
E.滴定管用蒸馏水洗净后未用标准液润洗.
7.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸若a=7,则HA是强酸;若a>7,则HA是弱酸.
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2否 (选填“是”或“否”).
(3)丙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5mol/L.
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | P H=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2否 (选填“是”或“否”).
(3)丙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5mol/L.

 ,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′ ,E中含氧官能团的名称醇羟基和羧基.
,E中含氧官能团的名称醇羟基和羧基. .
. .
. (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.