题目内容
1.下列说法正确的是( )| A. | 1mol酸与1mol碱完全反应放出的热量就是中和热 | |
| B. | 如果反应在加热时才能发生,则该反应是吸热反应 | |
| C. | 反应物总能量大于生成物总能量,则反应的△H<0 | |
| D. | 强酸强碱中和热的离子方程式可表示为:H+(aq)+OH-(aq)═H2O(l)△H=57.3 kJ/mol |
分析 A.中和热是指酸和碱的稀溶液中和,生成1mol水时放出的热量;
B.反应热与反应条件没有必然关系,则需要加热进行的反应不一定为吸热反应;
C.反应物总能量大于生成物总能量的反应为放热反应,焓变为负值;
D.中和反应为放热反应,则焓变为负值.
解答 解:A.1mol二元酸与1mol二元碱反应生成2mol水时放出的热量不是中和热,故A错误;
B.氢气、碳、CO与氧化铜的反应为吸热反应,该反应需要加热,所以在加热条件下进行的反应不一定为吸热反应,故B错误;
C.反应物总能量大于生成物总能量,该反应为放热反应,该反应的△H<0,故C正确;
D.稀的强酸强碱发生的中和反应为放热反应,焓变为负值,则其中和热的离子方程式可表示为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,故D错误;
故选C.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确中和热的概念为解答关键,注意掌握反应热与焓变的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
19.下列有关实验设计或操作、观察或记录、结论或解释都正确的是( )
| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| B | 向10mL 0.2mol/L AgNO3溶液中滴入2滴0.1mol/L NaCl溶液,产生白色沉淀后,再滴加2滴0.1mol/LKI溶液 | 白色沉淀转化为黄色沉淀 | 证明在相同温度下的Ksp:AgCl>AgI |
| C | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| D | 把SO2通入橙色的溴水中 | 橙色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
12.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图:
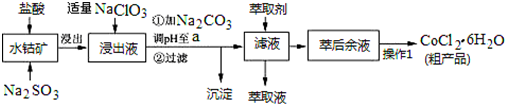
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)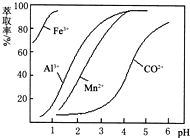

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

9.在25℃,101kPa下,1molH2充分燃烧生成液态水放热286kJ,下列说法中不正确的是( )
| A. | 相同条件下,2mol H2完全燃烧时液态水放热572kJ | |
| B. | 相同条件下,2mol H2O完全分解吸收热量572kJ | |
| C. | 相同条件下,1mol H2充分燃烧生成气态水放热大于286kJ | |
| D. | 形成1mol H2O的化学键所释放的能量大于断裂lmol H2和0.5mol O2的化学键所吸收的总能量 |
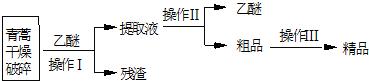
16.青蒿素是烃的含氧衍生物,为无色针状晶体.易溶于丙酮、氯仿和苯中,在水中几乎不溶,熔点为156-157℃.青蒿素是有效的抗疟药.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法.乙醚浸取法的主要工艺为:
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I的名称是过滤,操作II的名称是蒸馏.
(3)用下列实验装置测定青蒿素的分子式,将28.2g青蒿素放在硬质玻璃管C中充分燃烧:
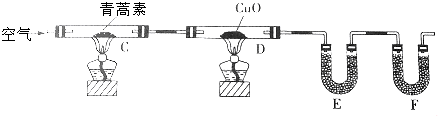
①装置E中盛放的物质是无水CaCl2或P2O5,装置F中盛放的物质是碱石灰.
②该实验装置可能产生误差,造成测定含氧量偏低,改进方法是除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置.
③已知青蒿素是烃的含氧衍生物,用合理改进后的装置进行实验,称得:
青蒿素的最简式是15H22O5.
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相似的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I的名称是过滤,操作II的名称是蒸馏.
(3)用下列实验装置测定青蒿素的分子式,将28.2g青蒿素放在硬质玻璃管C中充分燃烧:

①装置E中盛放的物质是无水CaCl2或P2O5,装置F中盛放的物质是碱石灰.
②该实验装置可能产生误差,造成测定含氧量偏低,改进方法是除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置.
③已知青蒿素是烃的含氧衍生物,用合理改进后的装置进行实验,称得:
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相似的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
10.现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
| A. | 加入10mL 的水进行稀释 | B. | 加水稀释成100mL | ||
| C. | 加入45mL 0.01mol/L的NaOH溶液 | D. | 加入10mL 0.01mol/L的盐酸溶液 |
11.中科院宁波材料所在金属空气电池的研发中获得重大突破.该电池的工作原理如图所示:

下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 电池工作时,负极附近溶液的pH升高 | |
| B. | 电路中转移2mol电子,理论上约消耗标准状况下空气56L | |
| C. | 电池工作时,电流由M极经外电路流向N极 | |
| D. | 电池总反应为4Al+3O2=2Al2O3、2Mg+O2=2MgO |