题目内容
质量相同的下列金属,分别跟足量盐酸完全反应产生氢气体积最多的是( )
| A、钠 | B、铝 | C、镁 | D、铁 |
考点:化学方程式的有关计算,常见金属元素的单质及其化合物的综合应用
专题:几种重要的金属及其化合物
分析:金属与盐酸反应生成盐(氯化物)与氢气,根据电子转移守恒,可知金属提供电子越多,相同条件下生成氢气体积越大.
解答:
解:假设金属均为1g,则:
Na提供电子为
×1=
mol,
Al提供电子为
×3=
mol,
Mg提供电子为
×2=
mol,
Fe提供电子为
×2=
mol,
根据电子转移守恒,可知金属提供电子越多生成氢气物质的量越大,相同条件下生成氢气体积越大,故Al生成氢气体积最多,
故选B.
Na提供电子为
| 1g |
| 23g/mol |
| 1 |
| 23 |
Al提供电子为
| 1g |
| 27g/mol |
| 1 |
| 9 |
Mg提供电子为
| 1g |
| 24g/mol |
| 1 |
| 12 |
Fe提供电子为
| 1g |
| 56g/mol |
| 1 |
| 28 |
根据电子转移守恒,可知金属提供电子越多生成氢气物质的量越大,相同条件下生成氢气体积越大,故Al生成氢气体积最多,
故选B.
点评:本题考查化学方程式的有关计算,比较基础,可以计算相等质量的金属反应生成氢气的质量,或计算生成相等质量的氢气时需要各金属的质量,注意对知识的灵活应用,

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量,则下列说法正确的是( )
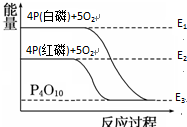

| A、白磷比红磷稳定 |
| B、白磷燃烧是吸热反应 |
| C、红磷转变为白磷是吸热反应 |
| D、红磷燃烧的热化学方程式:4P(s)+5O2(g)=P4O10(s)△H=(E2-E3)kJ/mol |
磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料,磷酸亚铁锂电池总反应为:FePO4+Li
LiFePO4,下列各种叙述不正确的是( )
| 放电 |
| 充电 |
| A、放电时,Li作负极 |
| B、电解质溶液为非水溶液体系 |
| C、充电时铁元素发生还原反应 |
| D、若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为1.4 g |
电离能是指蒸汽状态的孤立原子失去电子形成阳离子需要的能量.从中性原子中移去第一个电子生成+1价阳离子所需的能量为第一电离能(I1),移去第二个电子生成+2价阳离子所需要的能量为第二电离能(I2),依此类推.V、W、X、Y、Z是短周期元素,原子序数递增.下表是它们的电离能.单位为kJ/mol. 
下列说法正确的是( )

下列说法正确的是( )
| A、原子半径X>Y>Z>V>W |
| B、最高价氧化物的水化物的碱性:Z>Y>W |
| C、W的单质只有还原性,没有氧化性 |
| D、以Y、Z作为电极,硫酸作为电解质溶液的原电池中,Y做负极 |

