题目内容
磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料,磷酸亚铁锂电池总反应为:FePO4+Li
LiFePO4,下列各种叙述不正确的是( )
| 放电 |
| 充电 |
| A、放电时,Li作负极 |
| B、电解质溶液为非水溶液体系 |
| C、充电时铁元素发生还原反应 |
| D、若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为1.4 g |
考点:化学电源新型电池
专题:
分析:电池放电时原电池原理,Li失电子发生氧化反应做原电池负极,FePO4在正极得到电子发生还原反应生成LiFePO4;结合电解水计算电子转移,依据电子守恒和电极反应计算消耗锂的质量.
解答:
解:A、电池放电时原电池原理,Li失电子发生氧化反应做原电池负极,故A正确;
B、金属Li可以和水发生反应,所以电解质溶液为非水溶液体系,故B正确;
C、充电时Fe元素是失电子,化合价升高,发生氧化反应,故C错误;
D、FePO4在正极得到电子发生还原反应生成LiFePO4,电极反应为:FePO4+Li++e-=LiFePO4;若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,气体物质的量为0.2mol,生成氢气物质的量0.1mol,依据电子守恒和电极反应计算,
H2~2Li~2e-
0.1mol 0.2mol
消耗锂的质量=0.2mol×7g/mol=1.4g,故D正确.
故选C.
B、金属Li可以和水发生反应,所以电解质溶液为非水溶液体系,故B正确;
C、充电时Fe元素是失电子,化合价升高,发生氧化反应,故C错误;
D、FePO4在正极得到电子发生还原反应生成LiFePO4,电极反应为:FePO4+Li++e-=LiFePO4;若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,气体物质的量为0.2mol,生成氢气物质的量0.1mol,依据电子守恒和电极反应计算,
H2~2Li~2e-
0.1mol 0.2mol
消耗锂的质量=0.2mol×7g/mol=1.4g,故D正确.
故选C.
点评:本题考查化学电源新型电池:二次电池知识,本题难度不大,注意根据电池反应书写电极反应式的方法,明确离子的定向移动问题.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
下列化学用语书写正确的是( )
A、氯原子的结构示意图: | ||||||||
B、用电子式表示氯化氢分子的形成过程:H?:
| ||||||||
C、氯化镁的电子式: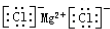 | ||||||||
| D、甲烷的结构式:CH4 |
有机物A含有C、H、O三种元素.A分子中含有一个羧基,且含碳40.0%、含氢约6.67%.将0.90gA配成100 mL溶液,取此溶液20.00 mL,用0.10 mol/LNaOH溶液滴定,至滴定终点时,消耗NaOH溶液20.00 mL.对有机物A的分析结论错误的是( )
| A、A的最简式为CH2O |
| B、A可以发生氧化反应,不能发生还原反应 |
| C、A的同分异构体中可能含有二元醛 |
| D、若A为羟基酸时,能生成六元或八元环状内酯 |
下述描述中,正确的是( )
| A、已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ.mol-1,N2(g)+O2(g)=2NO(g)△H=+180kJ.mol-1, 则2CO(g)+2NO(g)=N2(g)+2CO2(g);△H=-746kJ/mol | ||
B、由CH3(CH2)2CH3(g)+
| ||
| C、OH(aq)-+H(aq)+=H2O(l)△H=-57.3kJ.mol-1故1mol醋酸与1molOH完全反应,放出的热量一定为57.3kJ | ||
| D、已知P4(白磷,s)=4P(红磷,s)△H<0,则白磷比红磷稳定 |
下列化学用语正确的是( )
A、乙烯(电子式为H:
| ||||||||
B、CO2的球棍模型: | ||||||||
C、氯化镁的电子式: | ||||||||
D、K+的结构示意图: |
质量相同的下列金属,分别跟足量盐酸完全反应产生氢气体积最多的是( )
| A、钠 | B、铝 | C、镁 | D、铁 |
NA代表阿伏加德罗常数,下列有关叙述正确的是( )
| A、标准状况下,2.24 L H2O含有的分子数为0.1NA |
| B、标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10NA |
| C、分子数为NA的CO、C2H4混合气体体积为22.4 L,质量为28 g |
| D、3.4 g NH3中含N-H键数目为0.2NA |