题目内容
硫酸与盐酸的混合酸100mL,经测定其中的c(H+)=0.4mol/L,将100mL氢氧化钡溶液加入混合酸中使其充分反应,过滤后得到沉淀2.33克,滤液(假设体积为200mL)中c(OH-)=0.2mol/L.试求:
(1)原混合酸中H2SO4和HCl的物质的量?
(2)原氢氧化钡溶液的物质的量浓度?
(1)原混合酸中H2SO4和HCl的物质的量?
(2)原氢氧化钡溶液的物质的量浓度?
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据充分反应后过滤,得沉淀2.33g为硫酸钡的质量,氢氧根有剩余,酸完全反应,根据n=
计算硫酸钡的物质的量,利用H2SO4~BaSO4来计算硫酸的量;利用n(H+)=2n(H2SO4)+n(HCl)计算原混酸溶液中氢离子物质的量,根据n(HCl)=n(H+)解答;
(2)氢氧根有剩余,酸完全反应,n消耗(OH-)=n(H+),根据n消耗(OH-)+n剩余(OH-)=2n[Ba(OH)2],结合c=
计算;
| m |
| M |
(2)氢氧根有剩余,酸完全反应,n消耗(OH-)=n(H+),根据n消耗(OH-)+n剩余(OH-)=2n[Ba(OH)2],结合c=
| n |
| v |
解答:
解:沉淀2.33g为硫酸钡的质量,则:n(SO42-)=n(H2SO4)=n(BaSO4)=
=0.01mol,
原混合液中硫酸的物质的量为:0.01mol;硫酸与盐酸的混合酸100mL,经测定其中的c(H+)=0.4mol/L,则原n(H+)=0.4mol/L×0.1L=0.04mol,n(H+)=2n(H2SO4)+n(HCl)═0.04mol,原混合液中盐酸的物质的量为:n(HCl)═0.04mol-0.01mol×2=0.02mol,
答:原混合酸中H2SO4和HCl的物质的量分别为0.01mol、0.02mol;
(2)滤液(假设体积为200mL)中c(OH-)=0.2mol/L,n剩余(OH-)=c×v=0.2mol/L×0.2L=0.04mol,n消耗(OH-)+n剩余(OH-)=2n[Ba(OH)2],n消耗(OH-)=n(H+)=0.04mol,n[Ba(OH)2]=0.04mol,原氢氧化钡溶液的物质的量浓度c[Ba(OH)2]=
=
=0.4mol/L;
答:原氢氧化钡溶液的物质的量浓度为0.4mol/L;
| 2.33g |
| 233g/mol |
原混合液中硫酸的物质的量为:0.01mol;硫酸与盐酸的混合酸100mL,经测定其中的c(H+)=0.4mol/L,则原n(H+)=0.4mol/L×0.1L=0.04mol,n(H+)=2n(H2SO4)+n(HCl)═0.04mol,原混合液中盐酸的物质的量为:n(HCl)═0.04mol-0.01mol×2=0.02mol,
答:原混合酸中H2SO4和HCl的物质的量分别为0.01mol、0.02mol;
(2)滤液(假设体积为200mL)中c(OH-)=0.2mol/L,n剩余(OH-)=c×v=0.2mol/L×0.2L=0.04mol,n消耗(OH-)+n剩余(OH-)=2n[Ba(OH)2],n消耗(OH-)=n(H+)=0.04mol,n[Ba(OH)2]=0.04mol,原氢氧化钡溶液的物质的量浓度c[Ba(OH)2]=
| n |
| v |
| 0.04mol |
| 0.1L |
答:原氢氧化钡溶液的物质的量浓度为0.4mol/L;
点评:本题考查物质的量、物质的量浓度的计算等,题目难度中等,注意掌握物质的量浓度的概念及表达式,正确分析混合酸中氢离子的物质的量为解答本题的关键.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
我国南海海底蕴藏着丰富的锰结核--含有锰、铁、铜等金属的矿物.已知锰原子的质子数为25,相对原子质量为55,则锰原子的电子数为( )
| A、25 | B、30 | C、55 | D、80 |
下列化学用语书写正确的是( )
A、氯原子的结构示意图: | ||||||||
B、用电子式表示氯化氢分子的形成过程:H?:
| ||||||||
C、氯化镁的电子式: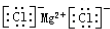 | ||||||||
| D、甲烷的结构式:CH4 |
下列解释正确的是( )
| A、物质的量就是物质的质量 |
| B、物质的量是一个独立的名词 |
| C、阿伏加德罗常数就是6.02×1023 |
| D、NA无单位 |
有机物A含有C、H、O三种元素.A分子中含有一个羧基,且含碳40.0%、含氢约6.67%.将0.90gA配成100 mL溶液,取此溶液20.00 mL,用0.10 mol/LNaOH溶液滴定,至滴定终点时,消耗NaOH溶液20.00 mL.对有机物A的分析结论错误的是( )
| A、A的最简式为CH2O |
| B、A可以发生氧化反应,不能发生还原反应 |
| C、A的同分异构体中可能含有二元醛 |
| D、若A为羟基酸时,能生成六元或八元环状内酯 |
下述描述中,正确的是( )
| A、已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ.mol-1,N2(g)+O2(g)=2NO(g)△H=+180kJ.mol-1, 则2CO(g)+2NO(g)=N2(g)+2CO2(g);△H=-746kJ/mol | ||
B、由CH3(CH2)2CH3(g)+
| ||
| C、OH(aq)-+H(aq)+=H2O(l)△H=-57.3kJ.mol-1故1mol醋酸与1molOH完全反应,放出的热量一定为57.3kJ | ||
| D、已知P4(白磷,s)=4P(红磷,s)△H<0,则白磷比红磷稳定 |
质量相同的下列金属,分别跟足量盐酸完全反应产生氢气体积最多的是( )
| A、钠 | B、铝 | C、镁 | D、铁 |
某元素的单质0.1mol与Cl2充分反应后,生成物的质量比原单质的质量增加了10.5g,则这种元素是( )
| A、K | B、Mg | C、Al | D、Cu |
 图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,打开K,接通电路后,发现B 上的 C 点显红色,请填空:
图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,打开K,接通电路后,发现B 上的 C 点显红色,请填空: