题目内容
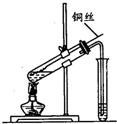 如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )
如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )| A、该实验说明浓硫酸具有强氧化性 |
| B、反应后试管中观察到的白色固体CuSO4 |
| C、该实验产生的气体不会造成环境污染,因此不需尾气处理 |
| D、实验结束,将铜丝拉离液面终止反应 |
考点:实验装置综合,浓硫酸的性质实验
专题:实验题
分析:加热条件下,浓硫酸与铜反应生成硫酸铜和二氧化硫气体,反应中硫酸表现强氧化性和酸性,生成二氧化硫气体有毒,不能直接排放到空气中,由于浓硫酸有吸水性,生成硫酸铜固体,以此解答该题.
解答:
解:A.反应生成硫酸铜和二氧化硫气体,浓硫酸被还原,表现出氧化性,故A正确;
B.将反应后的试管充分静置,观察到试管底部有白色固体出现,中间层是浅黄色液体(浓硫酸),上层是蓝色溶液,白色固体为硫酸铜,故B正确;
C.生成二氧化硫气体有毒,不能直接排放到空气中,故C错误;
D.实验结束,将铜丝拉离液面,铜与浓硫酸不接触,终止反应,故D正确.
故选C.
B.将反应后的试管充分静置,观察到试管底部有白色固体出现,中间层是浅黄色液体(浓硫酸),上层是蓝色溶液,白色固体为硫酸铜,故B正确;
C.生成二氧化硫气体有毒,不能直接排放到空气中,故C错误;
D.实验结束,将铜丝拉离液面,铜与浓硫酸不接触,终止反应,故D正确.
故选C.
点评:本题考查浓硫酸的性质,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验现象的判断,难度不大.

练习册系列答案
相关题目
下列分子中所有的原子都满足最外层为8电子结构的是( )
| A、BCl3 |
| B、COCl2 |
| C、SF6 |
| D、SiH4 |
一个价电子构型为2s22p5的元素,下列有关它的描述不正确的是( )
| A、原子序数为9 |
| B、电负性是所有元素中最大的 |
| C、原子半径是同周期元素中最小的 |
| D、第一电离能是所有元素中最大的 |
 某学生设计了一套验证物质化学性质的实验装置(如图),请观察该装置图,完成下列问题:
某学生设计了一套验证物质化学性质的实验装置(如图),请观察该装置图,完成下列问题:
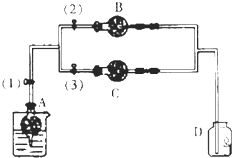 在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接.打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止.
在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接.打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止. 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.