题目内容
(1)金属铜在常温下与浓硝酸和稀硝酸都能发生反应,但反应的剧烈程度和部分产物不同,则金属铜与浓硝酸反应的化学方程式为: ;金属铜与稀硝酸反应的离子方程式为: .
(2))合成氨是人类科学技术发展史上一项重大突破,解决了地球上因粮食不足而导致的饥饿和死亡问题.氨可用于工业上制硝酸,其中的一步反应的化学方程式为:4NH3+5O2
4NO+6H2O其中还原剂是 (填化学式),若有68g NH3参加反应,转移电子的物质的量为 mol.
(2))合成氨是人类科学技术发展史上一项重大突破,解决了地球上因粮食不足而导致的饥饿和死亡问题.氨可用于工业上制硝酸,其中的一步反应的化学方程式为:4NH3+5O2
| ||
| △ |
考点:铜金属及其重要化合物的主要性质,化学方程式的有关计算,硝酸的化学性质
专题:元素及其化合物
分析:(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水;
(2)根据反应的化学方程式可知,氨气中氮元素的化合价从-3价升高到+2价,失去5个电子,据此分析即可.
(2)根据反应的化学方程式可知,氨气中氮元素的化合价从-3价升高到+2价,失去5个电子,据此分析即可.
解答:
解:(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+2H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+2H2O;
(2)根据反应的化学方程式可知,氨气中氮元素的化合价从-3价升高到+2价,失去5个电子,氧气中氧元素的化合价从0价降低到-2价,得到2个电子,所以还原剂是氨气,68g氨气的物质的量是68g÷17g/mol=4mol,所以反应中转移电子的物质的量是4mol×5=20mol,
故答案为:NH3;20.
(2)根据反应的化学方程式可知,氨气中氮元素的化合价从-3价升高到+2价,失去5个电子,氧气中氧元素的化合价从0价降低到-2价,得到2个电子,所以还原剂是氨气,68g氨气的物质的量是68g÷17g/mol=4mol,所以反应中转移电子的物质的量是4mol×5=20mol,
故答案为:NH3;20.
点评:本题考查了化学反应方程式的书写及方程式的计算,根据反应物、生成物及反应条件书写方程式,再结合物质之间的关系式结合原子守恒来分析解答,题目难度不大.

练习册系列答案
相关题目
在过量的稀硫酸溶液中加入5.6g Fe粉,待反应完全后,再加入50mL0.5mol?L-1KNO3溶液,恰好反应完全.该反应的方程式为:“ FeSO4+ KNO3+ H2SO4= K2SO4+ Fe2(SO4)3+ NxOy+ H2O”,则对该反应的下列说法正确的是( )
| A、反应中还原产物是NO |
| B、氧化产物和还原产物的物质的量之比为1:8 |
| C、反应过程中转移的电子数为4e- |
| D、化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5 |
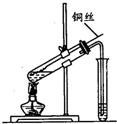 如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )
如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )| A、该实验说明浓硫酸具有强氧化性 |
| B、反应后试管中观察到的白色固体CuSO4 |
| C、该实验产生的气体不会造成环境污染,因此不需尾气处理 |
| D、实验结束,将铜丝拉离液面终止反应 |
下列实验过程中,始终无明显现象的是( )
| A、CO2通入饱和碳酸钠溶液中 |
| B、在稀硫酸中加入铜粉,再加入KNO3固体 |
| C、NO2通入FeSO4溶液中 |
| D、SO2通入饱和CaCl2溶液中 |
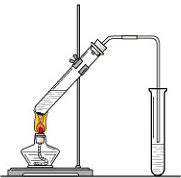 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
 实验室制取乙酸乙酯的主要步骤如图:
实验室制取乙酸乙酯的主要步骤如图: