题目内容
 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是
(2)加热前,大试管中加入几粒碎瓷片的作用是
(3)浓硫酸的作用
(4)饱和Na2CO3溶液的作用是
(5)实验生成的乙酸乙酯,其密度比水
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的化学方程式是
(7)有甲、乙、丙三位同学,分别将乙酸与乙醇反应得到的酯(未用饱和Na2CO3溶液承接)提纯,在未用指示剂的情况下,他们都是先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来.但他们的结果却不同:①甲得到了不溶于水的中性酯;②乙得到显酸性的酯的混合物;③丙得到大量水溶性物质.试分析产生上述各种现象的原因:
考点:乙酸乙酯的制取
专题:实验题
分析:(1)混合乙醇和浓硫酸的方法是先加入一定量的乙醇,然后边振荡边加入浓硫酸,防止酸液飞溅;
(2)给混合液加热时容易发生暴沸现象,加入碎瓷片可以防止暴沸;防止由于加热不均匀造成Na2CO3溶液倒流进加热反应物的试管中,导致试管破裂;
(3)酯化反应中浓硫酸起到催化剂的作用,可以加快反应速率,并且反应为可逆反应,浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动;
(4)实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:除去乙酸和乙醇,并降低乙酸乙酯的溶解度,增大水的密度,使酯浮于水面,容易分层析出,便于分离;
(5)乙酸乙酯在溶液上层,说明其密度比水小,低级酯有香味;
(6)乙醇在140℃、浓硫酸催化下生成乙醚,据此写出反应的化学方程式;
(7)根据NaOH能与酸、酯发生反应以及NaOH量的不同反应进行的程度不同进行解答.
(2)给混合液加热时容易发生暴沸现象,加入碎瓷片可以防止暴沸;防止由于加热不均匀造成Na2CO3溶液倒流进加热反应物的试管中,导致试管破裂;
(3)酯化反应中浓硫酸起到催化剂的作用,可以加快反应速率,并且反应为可逆反应,浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动;
(4)实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:除去乙酸和乙醇,并降低乙酸乙酯的溶解度,增大水的密度,使酯浮于水面,容易分层析出,便于分离;
(5)乙酸乙酯在溶液上层,说明其密度比水小,低级酯有香味;
(6)乙醇在140℃、浓硫酸催化下生成乙醚,据此写出反应的化学方程式;
(7)根据NaOH能与酸、酯发生反应以及NaOH量的不同反应进行的程度不同进行解答.
解答:
解:(1)为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,第一步是防止液体飞溅,原理和浓H2SO4加入水中是一个道理,冷却后加乙酸是因为防止过热乙酸挥发,
故答案为:先加入乙醇,然后沿着试管壁慢慢加入浓硫酸,冷却后再加乙酸;
(2)液体在加热过程中容易发生暴沸现象,所以加热前,大试管中加入几粒碎瓷片的作用是防止暴沸;
加热不均匀易造成Na2CO3溶液倒流进加热反应物的试管中,导致试管破裂,所以目的是防止倒吸,
故答案为:防止暴沸;防止倒吸;
(3)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动,
故答案为:催化剂、吸水剂;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠中和,易于除去杂质,还便于乙酸乙酯分层析出,
故答案为:溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度,便于分层析出;
(5)因乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,生成的乙酸乙酯密度小于水,且具有香味,
CH3COOCH2CH3+H2O,生成的乙酸乙酯密度小于水,且具有香味,
故答案为:小;果香;
(6)乙醇在加热到140℃,浓硫酸作催化下脱水生成乙醚,反应的化学方程式为:2CH3CH2OH
CH3CH2OCH2CH3+H2O,
故答案为:2CH3CH2OH
CH3CH2OCH2CH3+H2O;
(7)①甲得到了不溶于水的中性酯,没有酸,说明所加NaOH溶液恰好中和了过量的酸;
②乙得到显酸性的酯的混合物,酸有剩余,说明是所加NaOH溶液不足未将酸完全反应;
③丙得到大量水溶性物质,说明没有酯,是因为所加NaOH溶液过量,酯发生水解,
故答案为:①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯 ②乙同学加入碱量不足,所以蒸馏出来的有过量的酸,得到显酸性的酯的混合物 ③丙同学加入的碱过量使生成的酯已经水解为可溶性的醇和钠盐.
故答案为:先加入乙醇,然后沿着试管壁慢慢加入浓硫酸,冷却后再加乙酸;
(2)液体在加热过程中容易发生暴沸现象,所以加热前,大试管中加入几粒碎瓷片的作用是防止暴沸;
加热不均匀易造成Na2CO3溶液倒流进加热反应物的试管中,导致试管破裂,所以目的是防止倒吸,
故答案为:防止暴沸;防止倒吸;
(3)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动,
故答案为:催化剂、吸水剂;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠中和,易于除去杂质,还便于乙酸乙酯分层析出,
故答案为:溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度,便于分层析出;
(5)因乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应:CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O,生成的乙酸乙酯密度小于水,且具有香味,
CH3COOCH2CH3+H2O,生成的乙酸乙酯密度小于水,且具有香味,故答案为:小;果香;
(6)乙醇在加热到140℃,浓硫酸作催化下脱水生成乙醚,反应的化学方程式为:2CH3CH2OH
| 浓硫酸 |
| 140℃ |
故答案为:2CH3CH2OH
| 浓硫酸 |
| 140℃ |
(7)①甲得到了不溶于水的中性酯,没有酸,说明所加NaOH溶液恰好中和了过量的酸;
②乙得到显酸性的酯的混合物,酸有剩余,说明是所加NaOH溶液不足未将酸完全反应;
③丙得到大量水溶性物质,说明没有酯,是因为所加NaOH溶液过量,酯发生水解,
故答案为:①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯 ②乙同学加入碱量不足,所以蒸馏出来的有过量的酸,得到显酸性的酯的混合物 ③丙同学加入的碱过量使生成的酯已经水解为可溶性的醇和钠盐.
点评:本题考查了乙酸乙酯的制备方法及实验方案的设计与评价,题目难度中等,注意掌握乙酸乙酯的反应原理及实验室制法,明确正确的实验操作方法及浓硫酸、饱和碳酸钠溶液的作用为解答本题的关键,试题有利于提高学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
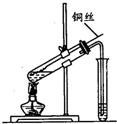 如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )
如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )| A、该实验说明浓硫酸具有强氧化性 |
| B、反应后试管中观察到的白色固体CuSO4 |
| C、该实验产生的气体不会造成环境污染,因此不需尾气处理 |
| D、实验结束,将铜丝拉离液面终止反应 |
下列有关元素非金属性的比较,正确的是( )
| A、进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 | ||
| B、HCl溶液的酸性比H2S溶液的酸性强,则Cl的非金属性比S强 | ||
C、2C+SiO2
| ||
| D、测定NaCl和NaF溶液的pH,可确定F、Cl两元素非金属性的强弱 |