题目内容
空气吹出发工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
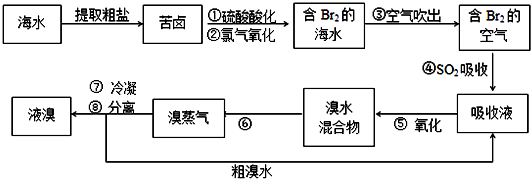
(1)步骤①中用硫酸酸化的目的是 .步骤②发生反应的离子方程式为 .
(2)步骤④利用了SO2的还原性,反应的离子方程式: .
(3)步骤⑥的名称是 .
(4)从含溴水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是:Na2CO3+Br2→NaBrO3+NaBr+CO2吸收1mol Br2 时,转移的电子数为 mol.纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出.
(5)化学上将SCN-、OCN-、CN-等离子称为“类卤离子”.现将KSCN溶液滴加到酸性Fe3+ 溶液中,溶液立即变成血红色;通入SO2后,血红色消失.血红色消失过程中发生反应的离子方程式为 .

(1)步骤①中用硫酸酸化的目的是
(2)步骤④利用了SO2的还原性,反应的离子方程式:
(3)步骤⑥的名称是
(4)从含溴水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是:Na2CO3+Br2→NaBrO3+NaBr+CO2吸收1mol Br2 时,转移的电子数为
(5)化学上将SCN-、OCN-、CN-等离子称为“类卤离子”.现将KSCN溶液滴加到酸性Fe3+ 溶液中,溶液立即变成血红色;通入SO2后,血红色消失.血红色消失过程中发生反应的离子方程式为
考点:海水资源及其综合利用
专题:
分析:(1)在酸性条件下不利于氯气、溴单质与水之间反应;
(2)根据了SO2的还原性和氯气的氧化性来书写二者之间的反应;
(3)沸点不同的互溶物质的分离可以采用蒸馏法;
(4)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
(5)根据信息:SCN-称为“类卤离子”,结合反应Br2+SO2+2H2O=4H++2Br-+SO42-来回答即可.
(2)根据了SO2的还原性和氯气的氧化性来书写二者之间的反应;
(3)沸点不同的互溶物质的分离可以采用蒸馏法;
(4)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
(5)根据信息:SCN-称为“类卤离子”,结合反应Br2+SO2+2H2O=4H++2Br-+SO42-来回答即可.
解答:
解:(1)氯气、溴单质与水之间能发生反应,酸化可抑制它们与水的反应,氯气能将溴离子氧化为溴单质,即Cl2+2Br-=Br2+2Cl-,故答案为:酸化可抑制Cl2、Br2与水反应;Cl2+2Br-=Br2+2Cl-;
(2)SO2和氯气、水反应生成硫酸和氢溴酸,即:Br2+SO2+2H2O=4H++2Br-+SO42-,故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)溴水的混合物中,将溴单质和水分离得到溴蒸汽可以采用蒸馏法,故答案为:蒸馏;
(4)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×
×5=
mol,
故答案为:
;
(5)将KSCN溶液滴加到酸性Fe3+ 溶液中,溶液立即变成血红色;通入SO2后,血红色消失,因为SCN-称为“类卤离子”,根据反应:Br2+SO2+2H2O=4H++2Br-+SO42-,推得,红色消失的过程中发生反应:2Fe(SCN)3+SO2+2H2O=4H++2Fe2++SO42-+6SCN-,故答案为:2Fe(SCN)3+SO2+2H2O=4H++2Fe2++SO42-+6SCN-.
(2)SO2和氯气、水反应生成硫酸和氢溴酸,即:Br2+SO2+2H2O=4H++2Br-+SO42-,故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)溴水的混合物中,将溴单质和水分离得到溴蒸汽可以采用蒸馏法,故答案为:蒸馏;
(4)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×
| 1 |
| 1+5 |
| 5 |
| 3 |
故答案为:
| 5 |
| 3 |
(5)将KSCN溶液滴加到酸性Fe3+ 溶液中,溶液立即变成血红色;通入SO2后,血红色消失,因为SCN-称为“类卤离子”,根据反应:Br2+SO2+2H2O=4H++2Br-+SO42-,推得,红色消失的过程中发生反应:2Fe(SCN)3+SO2+2H2O=4H++2Fe2++SO42-+6SCN-,故答案为:2Fe(SCN)3+SO2+2H2O=4H++2Fe2++SO42-+6SCN-.
点评:本题主要以海水化学资源的利用为背景,考查的知识点较多,培养了学生运用知识分析问题和解决问题的能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
将乙酸(其中的氧都18O标记)在浓硫酸存在条件下与足量的乙醇充分反应.下叙述不正确的是( )
| A、生成是水分子中含有18O |
| B、生成的乙酸乙酯相对分子质量为88 |
| C、生成的乙酸乙酯的相对分子质量为90 |
| D、此反应是有限度的 |
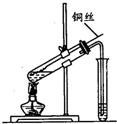 如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )
如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )| A、该实验说明浓硫酸具有强氧化性 |
| B、反应后试管中观察到的白色固体CuSO4 |
| C、该实验产生的气体不会造成环境污染,因此不需尾气处理 |
| D、实验结束,将铜丝拉离液面终止反应 |
下列有关元素非金属性的比较,正确的是( )
| A、进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 | ||
| B、HCl溶液的酸性比H2S溶液的酸性强,则Cl的非金属性比S强 | ||
C、2C+SiO2
| ||
| D、测定NaCl和NaF溶液的pH,可确定F、Cl两元素非金属性的强弱 |