题目内容
一个价电子构型为2s22p5的元素,下列有关它的描述不正确的是( )
| A、原子序数为9 |
| B、电负性是所有元素中最大的 |
| C、原子半径是同周期元素中最小的 |
| D、第一电离能是所有元素中最大的 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:价电子构型为2s22p5,则它的核外电子排布式应为1s22s22p5,所以它是9号元素,氟元素,是所有元素中电负性最大的元素,位于周期表第ⅥⅠA族,是同周期元素中半径最小的,但第一电离不是所有元素中最大的,它小于同周期及上周期的稀有气体元素,据此答题.
解答:
解:A、价电子构型为2s22p5,则它的核外电子排布式应为1s22s22p5,所以它是9号元素,氟元素,故A正确;
B、氟元素是所有元素中电负性最大的元素,故B正确;
C、氟元素位于周期表第ⅥⅠA族,同周期中随着原子序数的增加,原子半径逐渐减小,所以F是同周期元素中半径最小的,故C正确;
D、F的第一电离不是所有元素中最大的,它小于同周期及上周期的稀有气体元素,故D错误;
故选D.
B、氟元素是所有元素中电负性最大的元素,故B正确;
C、氟元素位于周期表第ⅥⅠA族,同周期中随着原子序数的增加,原子半径逐渐减小,所以F是同周期元素中半径最小的,故C正确;
D、F的第一电离不是所有元素中最大的,它小于同周期及上周期的稀有气体元素,故D错误;
故选D.
点评:本题主要以F元素为例考查了元素周期律,以及核外电子排布,难度不大,解题时要注意规律中的个别特殊情况.

练习册系列答案
相关题目
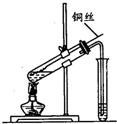 如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )
如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )| A、该实验说明浓硫酸具有强氧化性 |
| B、反应后试管中观察到的白色固体CuSO4 |
| C、该实验产生的气体不会造成环境污染,因此不需尾气处理 |
| D、实验结束,将铜丝拉离液面终止反应 |
下列实验过程中,始终无明显现象的是( )
| A、CO2通入饱和碳酸钠溶液中 |
| B、在稀硫酸中加入铜粉,再加入KNO3固体 |
| C、NO2通入FeSO4溶液中 |
| D、SO2通入饱和CaCl2溶液中 |
下列有关元素非金属性的比较,正确的是( )
| A、进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 | ||
| B、HCl溶液的酸性比H2S溶液的酸性强,则Cl的非金属性比S强 | ||
C、2C+SiO2
| ||
| D、测定NaCl和NaF溶液的pH,可确定F、Cl两元素非金属性的强弱 |
 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空: