题目内容
金属材料有着广泛的应用.下列说法错误的是( )
| A、用热碱液清洗铝材表面的油污时,会有气泡冒出 |
| B、电解精炼铜,电解结束后电解液浓度不变 |
| C、Fe2+、H+、NO3-三者不共存的原因为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
| D、硬铝是以铝为主要合金元素的合金材料,其熔点低于纯铝 |
考点:盐类水解的应用,电解原理,金属与合金在性能上的主要差异,铁盐和亚铁盐的相互转变
专题:元素及其化合物,化学应用
分析:A.Al能溶于强酸和强碱,生成盐和氢气;
B.电解精炼铜时,阳极上溶解的Cu小于阴极上析出的铜;
C.酸性条件下,硝酸根离子具有强氧化性,能氧化亚铁离子;
D.合金的熔点低于其任一成分的熔点.
B.电解精炼铜时,阳极上溶解的Cu小于阴极上析出的铜;
C.酸性条件下,硝酸根离子具有强氧化性,能氧化亚铁离子;
D.合金的熔点低于其任一成分的熔点.
解答:
解:A.碱会和铝反应放出氢气,所以有气体生成,故A正确;
B.电解过程中,在阳极上比铜活泼的金属如Zn、Pb失电子进入电解液,而在阴极上只能是Cu2+得电子,故电解后溶液中Cu2+浓度下降,故B错误;
C.在酸性条件下,NO3-会氧化Fe2+,生成Fe3+,自身被还原为NO,故C正确;
D硬铝的主要成分为铝,其余为Cu、Mg、Mn等,合金的熔点低于组成金属,故D正确;
故选C.
B.电解过程中,在阳极上比铜活泼的金属如Zn、Pb失电子进入电解液,而在阴极上只能是Cu2+得电子,故电解后溶液中Cu2+浓度下降,故B错误;
C.在酸性条件下,NO3-会氧化Fe2+,生成Fe3+,自身被还原为NO,故C正确;
D硬铝的主要成分为铝,其余为Cu、Mg、Mn等,合金的熔点低于组成金属,故D正确;
故选C.
点评:本题考查了电解原理、金属的性质、硝酸的性质等知识点,明确反应原理是解本题关键,易错选项是C,很多同学往往漏掉硝酸的强氧化性而导致错误,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
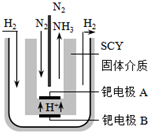 随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).下列有关说法中正确的是( )
随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).下列有关说法中正确的是( )| A、电解法合成氨的电解池中能用水作电解质溶液的溶剂 |
| B、钯电极B连接的是电源的负极 |
| C、钯电极A的电极反应式为:N2+6e-+6H+═2NH3 |
| D、当有0.3mol电子转移时,有2.688L NH3生成 |
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A、B与A只能形成化合物BA3 |
| B、C的原子半径、离子半径均分别小于D的原子半径、离子半径 |
| C、A、B、C形成的化合物可能促进水的电离,也可能抑制水的电离 |
| D、A、D均能与C形成原子个数比为1:1、2:1的化合物,且A2C2与D2C2的化学键类型相同 |
下列说法中正确的是( )
| A、布朗运动就是液体分子的热运动 |
| B、对一定质量的气体加热,其内能一定增加 |
| C、物体的温度越高,分子热运动越剧烈,分子的平均动能越大 |
| D、分子间的引力与斥力同时存在,斥力总是小于引力 |
下列各组离子在指定环境中一定能大量共存的是( )
| A、在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- |
| B、c(OH-)=10-13mol?L-1的溶液中:SO32-、CO32-、Na+、K+ |
| C、在含有大量Fe3+的溶液中:Cu2+、Cl-、NO3-、S2- |
| D、加入Mg能放出H2的溶液中:K+、NH4+、Cl-、SO42- |
A、B、C均为中学常见的单质或化合物,一定条件下,存在转化关系:A+H2O→B+C.下列说法正确的是( )
| A、若B为强碱,则A一定为金属钠 |
| B、若B为强酸,则A一定为氯气 |
| C、若C为H2,则H2O一定作氧化剂 |
| D、若C为O2,则H2O一定作还原剂 |
下列叙述正确的是( )
| A、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
B、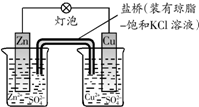 如图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| C、氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-═2H2O |
| D、电镀时,通常把待镀的金属制品作阳极 |