题目内容
A、B、C均为中学常见的单质或化合物,一定条件下,存在转化关系:A+H2O→B+C.下列说法正确的是( )
| A、若B为强碱,则A一定为金属钠 |
| B、若B为强酸,则A一定为氯气 |
| C、若C为H2,则H2O一定作氧化剂 |
| D、若C为O2,则H2O一定作还原剂 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A.若B为强碱,A应为碱金属;
B.若B为强酸,A应为卤素单质(氟除外);
C.若C为H2,反应中H元素的化合价降低;
D.若C为O2,A可能为过氧化钠.
B.若B为强酸,A应为卤素单质(氟除外);
C.若C为H2,反应中H元素的化合价降低;
D.若C为O2,A可能为过氧化钠.
解答:
解:A.若B为强碱,A应为碱金属,如K与水反应上次KOH,故A错误;
B.若B为强酸,A应为卤素单质(氟除外),如A为Br2,生成HBr为强酸,故B错误;
C.若C为H2,反应中H元素的化合价降低,则H2O一定作氧化剂,故C正确;
D.若C为O2,A可能为过氧化钠,水既不是氧化剂也不是还原剂,故D错误;
故选C.
B.若B为强酸,A应为卤素单质(氟除外),如A为Br2,生成HBr为强酸,故B错误;
C.若C为H2,反应中H元素的化合价降低,则H2O一定作氧化剂,故C正确;
D.若C为O2,A可能为过氧化钠,水既不是氧化剂也不是还原剂,故D错误;
故选C.
点评:本题考查氧化还原反应,为高频考点,把握常见物质的性质及反应中元素的化合价变化为解答的关键,注意利用实例分析解答,题目难度不大.

练习册系列答案
相关题目
金属材料有着广泛的应用.下列说法错误的是( )
| A、用热碱液清洗铝材表面的油污时,会有气泡冒出 |
| B、电解精炼铜,电解结束后电解液浓度不变 |
| C、Fe2+、H+、NO3-三者不共存的原因为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
| D、硬铝是以铝为主要合金元素的合金材料,其熔点低于纯铝 |
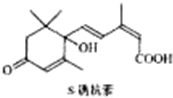 对盆栽鲜花施用S-诱抗素制剂,可以保持鲜花盛开.S-诱抗素的分子结构如图,则1mol该物质与足量的NaOH溶液反应时最多可消耗NaOH的物质的量为( )
对盆栽鲜花施用S-诱抗素制剂,可以保持鲜花盛开.S-诱抗素的分子结构如图,则1mol该物质与足量的NaOH溶液反应时最多可消耗NaOH的物质的量为( )| A、1mol | B、2mol |
| C、3mol | D、4mol |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
| B、在0.1mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | ||
| C、在0.1mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
D、在
|
人们的生活,生产与化学息息相关,下列说法不正确的是( )
| A、在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B、地沟油经过处理后可作为汽车燃油,故地沟油主要成分是液态烃 |
| C、实施化石燃科脱硫,脱硝可以减少硫的氧化物和氮的氧化物的排放 |
| D、雾霾天气中的主要污染物是PM2.5,其中含氮的有机物和光发生化学作用,可形成光化学烟雾 |
下列有关实验的叙述正确的是( )
| A、用浓硝酸做试剂比较铁和铜的金属活动性 |
| B、用干燥洁净的玻璃棒蘸取氯水滴在干燥PH试纸上,测定氯水的PH |
| C、向两只分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高 |
| D、欲检验Br-的存在,可在溶液中先加入氯水,再加入CCl4,振荡、静置,观察下层溶液是否出现橙红色 |
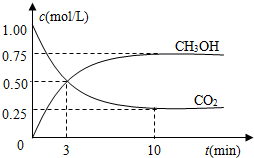 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.