题目内容
13. 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:(1)该反应的化学方程式为X+3Y?2Z.
(2)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:①此时体系的压强是开始时的0.9倍;
②达平衡时,容器内混合气体的平均分子量比起始投料时增大(填“增大”“减小”或“相等”).
分析 (1)由图可知,Y、X的物质的量减少,为反应物,而Z的物质的量增加,则Z为生成物,结合△n之比等于化学反应速率之比判断反应;
(2)①开始的物质的量为1.0mol+1.0mol=2.0mol,2min后反应达到平衡,平衡时总物质的量为0.9mol+0.7mol+0.2mol=1.8mol,物质的量比等于压强比;
②由物质的量变化可知,该反应为气体总物质的量减小的反应,结合M=$\frac{m}{n}$判断.
解答 解:(1)由图可知,Y、X的物质的量减少,为反应物,而Z的物质的量增加,则Z为生成物,结合△n之比等于化学反应速率之比可知,X、Y、Z的化学计量数比为(1-0.9):(1-0.7):(0.2-0)=1:3:2,且2min反应达到平衡,则反应为X+3Y?2Z,
故答案为:X+3Y?2Z;
(2)①开始的物质的量为1.0mol+1.0mol=2.0mol,2min后反应达到平衡,平衡时总物质的量为0.9mol+0.7mol+0.2mol=1.8mol,物质的量比等于压强比,则此时体系的压强是开始时的$\frac{1.8}{2}$=0.9倍,
故答案为:0.9;
②由物质的量变化可知,该反应为气体总物质的量减小的反应,由M=$\frac{m}{n}$可知,气体的总质量不变,n减小,则达平衡时,容器内混合气体的平均分子量比起始投料时增大,
故答案为:增大.
点评 本题考查物质的量随时间变化的曲线,为高频考点,把握物质的量变化、压强比的计算、摩尔质量的计算等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.某微粒的核外电子排布式为1s22s22p6,下列说法不正确的是( )
| A. | 可以确定该微粒为Ne | |
| B. | 对应元素的单质可能是强还原剂 | |
| C. | 对应元素可能是电负性最大的元素 | |
| D. | 对应元素可能位于元素周期表中第13列 |
4.配制100mL 0.01mol•L-1KOH溶液时,必须用到的仪器是( )
| A. | 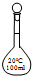 100mL容量瓶 100mL容量瓶 | B. |  100mL集气瓶 | C. | 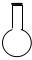 100mL烧瓶 | D. |  100mL滴瓶 100mL滴瓶 |
18.化学反应的实质是( )
| A. | 能量的转移 | B. | 旧化学键断裂和新化学键生成 | ||
| C. | 电子转移 | D. | 原子种类与原子数目保持不变 |
5.饱和二氧化硫水溶液中存在下列平衡体系:
SO2+H2O?H++HSO3-
HSO3-?H++SO3-
若向此溶液中( )
SO2+H2O?H++HSO3-
HSO3-?H++SO3-
若向此溶液中( )
| A. | 加水,SO3-浓度增大 | |
| B. | 通入少量Cl2气体,溶液pH增大 | |
| C. | 加少量CaSO3粉末,HSO3-浓度基本不变 | |
| D. | 通入少量HCl气体,溶液中HSO3-浓度减小 |
3.模拟电渗析法将海水淡化的工作原理示意图如下.已知X、Y均为惰性电极,模拟海水中富含Na+、Cl-、Ca2+、Mg2+、SO42-、HCO3-等离子.下列叙述中正确的是( )


| A. | M是阴离子交换膜 | B. | Y电极上产生无色气体 | ||
| C. | X电极区域可产生Mg(OH)2 | D. | X电极反应式为4OH--4e-═O2↑+2H2O |
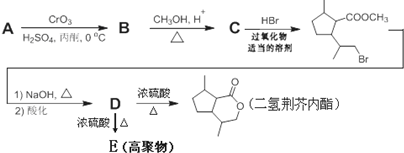
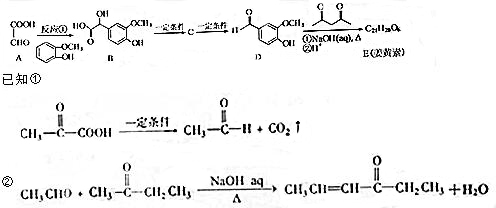
 ,B含有的非氧官能团的名称碳碳双键.C与HBr发生的反应类型是加成反应.
,B含有的非氧官能团的名称碳碳双键.C与HBr发生的反应类型是加成反应.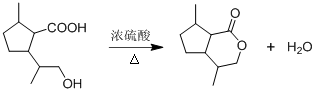 .
. .
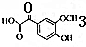
. ,其分子中最多有8个碳原子在同一平面上.
,其分子中最多有8个碳原子在同一平面上.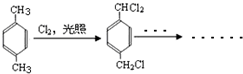

 .
. .
.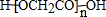 .
. ,下列有关E的叙述正确的是ac.
,下列有关E的叙述正确的是ac.