题目内容
3.模拟电渗析法将海水淡化的工作原理示意图如下.已知X、Y均为惰性电极,模拟海水中富含Na+、Cl-、Ca2+、Mg2+、SO42-、HCO3-等离子.下列叙述中正确的是( )
| A. | M是阴离子交换膜 | B. | Y电极上产生无色气体 | ||
| C. | X电极区域可产生Mg(OH)2 | D. | X电极反应式为4OH--4e-═O2↑+2H2O |
分析 A.阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;
B.Y电极上氯离子放电生成氯气;
C.X电极上水得电子生成氢气同时生成OH-,Mg(OH)2难溶于水;
D.X电极上生成氢气.
解答 解:A.阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜M和阴极相连,阴极是阳离子放电,所以隔膜M是阳离子交换膜,故A错误;
B.Y电极上氯离子放电生成氯气,氯气是黄绿色气体,故B错误;
C.X电极上水得电子生成氢气同时生成OH-,Mg(OH)2难溶于水,镁离子和氢氧根离子反应生成白色沉淀Mg(OH)2,故C正确;
D.X电极上生成氢气,电极反应式为2H2O+4e-═2H2↑+2OH-,故D错误;
故选C.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断能力,明确各个电极上发生的反应、离子交换膜特点是解本题关键,注意结合离子共存解答,题目难度不大.

练习册系列答案
相关题目
14.下列对相关实验操作的说法中,一定正确的是( )
| A. | 实验室配制480 mL 0.1 mol/L NaOH溶液,需要准确称量NaOH 1.920 g | |
| B. | 学生实验测定硫酸铜晶体中结晶水含量时,通常至少称量4次 | |
| C. | 酸碱中和滴定实验中只能用标准液滴定待测液 | |
| D. | 分液时,分液漏斗中下层液体从下口放出后,换一容器再从下口放出上层液体 |
11. 工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:
工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:
I CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-58kJ.mol-l
ⅡCO(g)+2H2(g)?CH30H(g)△H2=-99kj.mol-l
ⅢCO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ.mol-l
在压强分别为Pi.P2且起始$\frac{n({H}_{2})}{n(CO)+n(C{O}_{2})}$为一定值条件下,反应体系平衡时CO的转化率(a)与温度关系如图.下列分析正确的是( )
 工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:
工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:I CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-58kJ.mol-l
ⅡCO(g)+2H2(g)?CH30H(g)△H2=-99kj.mol-l
ⅢCO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ.mol-l
在压强分别为Pi.P2且起始$\frac{n({H}_{2})}{n(CO)+n(C{O}_{2})}$为一定值条件下,反应体系平衡时CO的转化率(a)与温度关系如图.下列分析正确的是( )
| A. | 由图可知:Pl<P2 | |
| B. | 升高温度反应Ⅱ的平衡常数减小 | |
| C. | 恒压绝热下向反应器中加Ar(g).反应Ⅲ一定不移动 | |
| D. | 其它条件不变,起始时改变CO和CO2比例,平衡时CO转化率不变 |
8.下列叙述不正确的是( )
| A. | “蜡炬成灰泪始干”既包含物理变化又包含化学变化 | |
| B. | Al2O3熔点高,可用于制作耐高温仪器 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油(主要成分是脂肪烃) |
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
 .
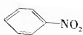
.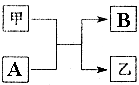 单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:
单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题: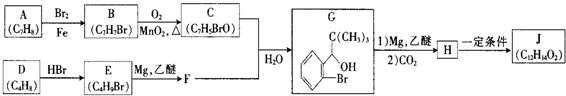
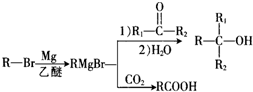
 .
. +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$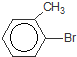 +HBr,反应类型为取代反应.
+HBr,反应类型为取代反应.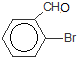 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
. 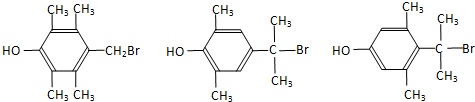 任意2种.
任意2种.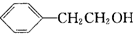
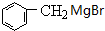 .
.
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (苯胺,易被氧化);
(苯胺,易被氧化); ,最多有13个原子共面.
,最多有13个原子共面.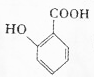 的名称为邻羟基苯甲酸,G中官能团名称为羧基、硝基.
的名称为邻羟基苯甲酸,G中官能团名称为羧基、硝基. .
.