题目内容
1.将猫薄荷中分离出的荆芥内酯与等物质的量的氢气进行加成,得到的二氢荆芥内酯是一种有效的驱虫剂,可用于商业生产.如图为二氢荆芥内酯的一种合成路线.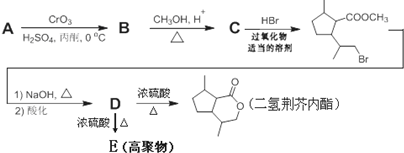
已知:A(C10H16O)的结构中有一个五元环,能发生银镜反应.回答下列问题:
(1)A的结构简式为
 ,B含有的非氧官能团的名称碳碳双键.C与HBr发生的反应类型是加成反应.
,B含有的非氧官能团的名称碳碳双键.C与HBr发生的反应类型是加成反应.(2)由D生成二氢荆芥内酯的化学方程式为
 .
.(3)D在某催化剂作用下可发生反应生成一种高聚物,其结构简式为
 .
.(4)写出符合以下条件的荆芥内酯的同分异构体的结构简式
 ,其分子中最多有8个碳原子在同一平面上.
,其分子中最多有8个碳原子在同一平面上.①结构中含有苯环 ②只有一个侧链 ③能发生酯化反应 ④不能发生消去反应
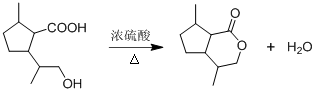
(5)已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮.完成下列合成内酯路线:
分析 A的分子式为C10H16O,不饱和度为$\frac{2×10+2-16}{2}$=3,A的结构中有一个五元环,结合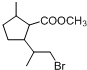 的结构可知A为
的结构可知A为 ,A发生氧化反应得到B为
,A发生氧化反应得到B为 ,B与甲醇发生转化反应得到C为
,B与甲醇发生转化反应得到C为 ,C再与HBr反应加成反应得到
,C再与HBr反应加成反应得到 ,在碱性条件下发生水解反应、酸化得到D为
,在碱性条件下发生水解反应、酸化得到D为 ,D发生酯化反应得到二氢荆芥内酯,D发生缩聚反应得到高聚物E为
,D发生酯化反应得到二氢荆芥内酯,D发生缩聚反应得到高聚物E为 .
.
解答 解:A的分子式为C10H16O,不饱和度为$\frac{2×10+2-16}{2}$=3,A的结构中有一个五元环,结合 的结构可知A为
的结构可知A为 ,A发生氧化反应得到B为
,A发生氧化反应得到B为 ,B与甲醇发生转化反应得到C为
,B与甲醇发生转化反应得到C为 ,C再与HBr反应加成反应得到
,C再与HBr反应加成反应得到 ,在碱性条件下发生水解反应、酸化得到D为
,在碱性条件下发生水解反应、酸化得到D为 ,D发生酯化反应得到二氢荆芥内酯,D发生缩聚反应得到高聚物E为
,D发生酯化反应得到二氢荆芥内酯,D发生缩聚反应得到高聚物E为 .
.
(1)A的结构简式为 ,B为
,B为 ,含有的非氧官能团为碳碳双键,C与HBr发生的反应类型是加成反应,
,含有的非氧官能团为碳碳双键,C与HBr发生的反应类型是加成反应,
故答案为: ;碳碳双键;加成反应;
;碳碳双键;加成反应;
(2)由D生成二氢荆芥内酯的化学方程式为: ,
,
故答案为: ;
;
(3)D为 ,含有羧基、羟基,在某催化剂作用下可发生羧基反应,生成一种高聚物的结构简式为
,含有羧基、羟基,在某催化剂作用下可发生羧基反应,生成一种高聚物的结构简式为 ,
,
故答案为: ;
;
(4)符合以下条件的二氢荆芥内酯的同分异构体:①结构中含有苯环,则侧链没有不饱和键; ②只有一个侧链,③能发生酯化反应,含有羟基,④不能发生消去反应,该同分异构体结构简式为: ,苯环为平面结构,旋转碳碳单键可以使亚甲基或甲基中碳原子处于苯的平面结构内,最多有8个碳原子处于同一平面内,
,苯环为平面结构,旋转碳碳单键可以使亚甲基或甲基中碳原子处于苯的平面结构内,最多有8个碳原子处于同一平面内,
故答案为: ;8.
;8.
(5)已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮.完成下列合成内酯路线: ,补全合成路线流程图为:
,补全合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用合成路线中物质的结构简式、反应条件进行推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生分析推理能力、知识迁移运用能力,难度中等.

| A. | CH3CH2CH2CH3 | B. | CH2=CH-CH3 | C. | CH2=CH-CH2-CH3 | D. | CH2=C(CH3)2 |
| A. | 2种 | B. | 4种 | C. | 9种 | D. | 13种 |
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)①~⑨九种元素中非金属性最强的是F(填元素符号).
(2)元素⑧的原子结构示意图是
 .
.(3)元素②、⑧的气态氢化物的稳定性较强的是CH4(填化学式);元素⑥、⑦的最高价氧化物对应的水化物的碱性较强的是NaOH(填化学式).
(4)②、③、⑧三种元素的原子半径由大到小的顺序是Si>C>N(填元素符号).
(5)元素⑤、⑥组成的化合物的化学键类型是离子键.
(6)元素⑥的最高价氧化物对应的水化物与元素⑨的氢化物溶于水形成的溶液反应的离子方程式是H++OH-=H2O.
 工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:
工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:I CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-58kJ.mol-l
ⅡCO(g)+2H2(g)?CH30H(g)△H2=-99kj.mol-l
ⅢCO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ.mol-l
在压强分别为Pi.P2且起始$\frac{n({H}_{2})}{n(CO)+n(C{O}_{2})}$为一定值条件下,反应体系平衡时CO的转化率(a)与温度关系如图.下列分析正确的是( )
| A. | 由图可知:Pl<P2 | |
| B. | 升高温度反应Ⅱ的平衡常数减小 | |
| C. | 恒压绝热下向反应器中加Ar(g).反应Ⅲ一定不移动 | |
| D. | 其它条件不变,起始时改变CO和CO2比例,平衡时CO转化率不变 |
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: ,写出CO2的电子式
,写出CO2的电子式 .
.