题目内容
4.配制100mL 0.01mol•L-1KOH溶液时,必须用到的仪器是( )| A. | 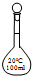 100mL容量瓶 100mL容量瓶 | B. |  100mL集气瓶 | C. |  100mL烧瓶 | D. |  100mL滴瓶 100mL滴瓶 |
分析 配制100mL 0.01mol•L-1KOH溶液步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,根据配制步骤选择使用的仪器.
解答 解:配制100mL 0.50mol•L-1 KOH溶液过程中使用的仪器有:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,所以必须使用的仪器为100mL容量瓶,不会使用到100mL集气瓶、100mL烧瓶和100mL滴瓶,
故选A.
点评 本题考查了配制一定物质的量浓度的溶液中仪器选择,掌握配制一定物质的量浓度的溶液的步骤及正确的操作是解题关键,题目难度不大.

练习册系列答案
相关题目
14.对原子核外电子以及电子的运动,下列描述正确的是( )
①可以测定某一时刻电子在原子中所处的位置
②电子质量很小且带负电荷
③电子在原子里有“广阔”的运动空间
④运动速度接近光速
⑤与宏观物体一样有固定的运动轨道
⑥现代最先进的扫描隧道显微镜也观察不到电子的运动.
①可以测定某一时刻电子在原子中所处的位置
②电子质量很小且带负电荷
③电子在原子里有“广阔”的运动空间
④运动速度接近光速
⑤与宏观物体一样有固定的运动轨道
⑥现代最先进的扫描隧道显微镜也观察不到电子的运动.
| A. | ①②③⑥ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | ⑤⑥ |
15.晶体是一类非常重要的材料,在很多领域都有广泛的应用.我国现已能够拉制出直径为300毫米,重量达81千克的大直径硅单晶,晶体硅大量用于电子产业.下列对晶体硅的叙述正确的是( )
| A. | 晶体硅没有固定的熔沸点 | |
| B. | 形成晶体硅的速率越快越好 | |
| C. | 可用于X-射线衍射实验来鉴别晶体硅和玻璃 | |
| D. | 晶体硅的形成与晶体的自范性有关,形成的晶体无各向异性 |
12.分子式为C5H10O2的有机物X,在酸性条件能够发生水解反应生成相对分子质量相等的两种有机物,符合条件的有机物X有( )
| A. | 2种 | B. | 4种 | C. | 9种 | D. | 13种 |
9.下表列出了①~⑨九种元素在周期表中的位置.
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是F(填元素符号).
(2)元素⑧的原子结构示意图是 .
.
(3)元素②、⑧的气态氢化物的稳定性较强的是CH4(填化学式);元素⑥、⑦的最高价氧化物对应的水化物的碱性较强的是NaOH(填化学式).
(4)②、③、⑧三种元素的原子半径由大到小的顺序是Si>C>N(填元素符号).
(5)元素⑤、⑥组成的化合物的化学键类型是离子键.
(6)元素⑥的最高价氧化物对应的水化物与元素⑨的氢化物溶于水形成的溶液反应的离子方程式是H++OH-=H2O.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)①~⑨九种元素中非金属性最强的是F(填元素符号).
(2)元素⑧的原子结构示意图是
 .
.(3)元素②、⑧的气态氢化物的稳定性较强的是CH4(填化学式);元素⑥、⑦的最高价氧化物对应的水化物的碱性较强的是NaOH(填化学式).
(4)②、③、⑧三种元素的原子半径由大到小的顺序是Si>C>N(填元素符号).
(5)元素⑤、⑥组成的化合物的化学键类型是离子键.
(6)元素⑥的最高价氧化物对应的水化物与元素⑨的氢化物溶于水形成的溶液反应的离子方程式是H++OH-=H2O.
14.下列对相关实验操作的说法中,一定正确的是( )
| A. | 实验室配制480 mL 0.1 mol/L NaOH溶液,需要准确称量NaOH 1.920 g | |
| B. | 学生实验测定硫酸铜晶体中结晶水含量时,通常至少称量4次 | |
| C. | 酸碱中和滴定实验中只能用标准液滴定待测液 | |
| D. | 分液时,分液漏斗中下层液体从下口放出后,换一容器再从下口放出上层液体 |


 .
. ,F
,F ;
;
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: