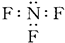题目内容
18.通过14C标记的C60进行跟踪研究,医学界发现了一种C60的羧酸衍生物在特定的条件下可通过断裂DNA杀死艾滋病病毒.有关C60和14C的叙述正确的是( )| A. | 12C60与14C60互为同位素 | |
| B. | 14C转变为12C的过程属于化学变化 | |
| C. | 12C与14C的原子中含有的中子数之比为3:4 | |
| D. | 金刚石与C60都属于原子晶体 |
分析 A.同位素研究同元素的不同原子;
B.原子间的变化属于物理变化;
C.中子数=质量数-质子数;
D.相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体.
解答 解:A.12C60与14C60,属于单质不属于原子,故A错误;
B.原子间的变化属于物理变化,故B错误;
C.中子数=质量数-质子数,12C与14C的原子中含有的中子数分别为6、8,中子数之比为3:4,故C正确;
D.C60 之间的相互作用力是范德华力,属于分子晶体,故D错误.
故选C.
点评 本题考查同素异形体、原子构成、晶体类型等,题目难度不大,注意原子符号左上角的数字为质量数.

练习册系列答案
相关题目
8.有关接触法制硫酸,下列说法中不正确的是( )
| A. | 用硫和硫铁矿均可做为原料 | |
| B. | SO2转化为SO3,需在催化剂和加热条件下进行 | |
| C. | SO3可用水直接吸收 | |
| D. | 热交换器可对生成气体冷却,对原料气体加热 |
6.下列说法不正确的是( )
| A. | SO2能与H2O2反应生成H2SO4 | |
| B. | 利用Cl2与石灰乳反应可以制取漂白粉 | |
| C. | Cl2能使紫色石蕊试液先变红后褪色 | |
| D. | 红热的铁丝能在Cl2中剧烈燃烧产生大量的白烟 |
13.下列物质的制备,符合工业生产实际的是( )
| A. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 | |
| B. | 工业上用接触法制硫酸,在接触室里制出硫酸 | |
| C. | 工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅 | |
| D. | 工业上主要从海水中提取碘 |
3.下列叙述正确的是( )
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 元素的性质呈周期性变化的根本原因是核外电子排布呈周期性变化 | |
| C. | 第IA族元素与第VIIA族元素形成的化合物都是离子化合物 | |
| D. | 元素周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |