题目内容
10.下列说法中正确的是( )①非金属元素构成的单质中一定存在共价键
②非金属之间形成的化合物一定是共价化合物
③化学键断裂过程中,一定发生了化学变化
④晶体中含有阴离子,一定含有阳离子;晶体中含有阳离子,不一定有阴离子
⑤金属元素和非金属元素形成的化合物一定是离子化合物
⑥在一种化合物中只能存在一种类型的化学键
⑦含共价键的化合物不一定是共价化合物
⑧含离子键的化合物一定是离子化合物
⑨判断一种化合物是否为离子化合物的方法是测其熔化状态下能否导电.
| A. | ①④⑦⑧ | B. | ③④⑦⑧ | C. | ②⑤⑧⑨ | D. | ④⑦⑧⑨ |
分析 非金属原子间主要形成共价键,但稀有气体中无化学键,只含有共价键的化合物属于共价化合物;阴阳离子间形成离子键,含有离子键的化合物一定是离子化合物,但离子化合物中也可能含有共价键,在熔融状态下能导电的化合物一定属于离子化合物;化学反应一定有旧键的断裂和新键的形成,据此回答.
解答 解:①非金属元素构成的单质中不一定存在共价键,如稀有气体,故错误;
②非金属之间形成的化合物不一定是共价化合物,如氯化铵属于离子化合物,故错误;
③化学键断裂过程中,不一定发生了化学变化,如氯化氢溶于水,故错误;
④晶体中含有阴离子,一定含有阳离子;晶体中含有阳离子,不一定有阴离子,正确;
⑤金属元素和非金属元素形成的化合物不一定是离子化合物,如氯化铝属于共价化合物,故错误;
⑥在一种化合物中可能存在2种类型的化学键,如氯化铵中含有离子键和共价键,故错误;
⑦含共价键的化合物不一定是共价化合物,如氯化铵中含有共价键,但属于离子化合物,故错误;
⑧含离子键的化合物一定是离子化合物,正确;
⑨在熔化状态下能否导电的化合物一定属于离子化合物,故正确.
故选D.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,明确离子键和共价键的区别是解本题关键,注意不能根据是否含有金属元素判断离子键,采用举例法分析解答.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
20.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4LN2中含有π健数为3NA | |
| B. | 12g金刚石中含有C-C键数为4NA | |
| C. | 25℃时,pH=12的CH3COONa溶液中水电离出的OH-的数目为0.01NA | |
| D. | 当反应3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+3SO2↑+N2↑+6H2O生成89.6L标准状况的气体时,转移的电子数为3NA |
1.能正确表示下列化学反应的离子方程式是( )
| A. | 碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氯气溶于水:Cl2+H2O?2H++Cl一+ClO一 | |
| C. | 过量二氧化碳与石灰水反应:CO2+2OH一=CO32一+H2O | |
| D. | 利用腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+ |
18.通过14C标记的C60进行跟踪研究,医学界发现了一种C60的羧酸衍生物在特定的条件下可通过断裂DNA杀死艾滋病病毒.有关C60和14C的叙述正确的是( )
| A. | 12C60与14C60互为同位素 | |
| B. | 14C转变为12C的过程属于化学变化 | |
| C. | 12C与14C的原子中含有的中子数之比为3:4 | |
| D. | 金刚石与C60都属于原子晶体 |
5.下列实验事实:
①常温下S为固体,而Cl2为气体;
②Cl2与H2混合,强光照射剧烈反应,而S与H2反应需较高温度;
③Cl2与Fe反应,Cl2生成FeCl3,而S与Fe生成FeS;
④盐酸是强酸,而氢硫酸是弱酸;
⑤将Cl2通入氢硫酸中可置换出S
能说明Cl的非金属性比S强的事实有( )
①常温下S为固体,而Cl2为气体;
②Cl2与H2混合,强光照射剧烈反应,而S与H2反应需较高温度;
③Cl2与Fe反应,Cl2生成FeCl3,而S与Fe生成FeS;
④盐酸是强酸,而氢硫酸是弱酸;
⑤将Cl2通入氢硫酸中可置换出S
能说明Cl的非金属性比S强的事实有( )
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ②③④⑤ |
15.表为元素周期表的一部分,用元素符号或化学用语回答下列问题.
(1)10种元素中,化学性质最不活泼的是Ar,除⑩外原子半径最大的是K
(2)①、②、④、⑧四种元素形成的离子半径由大到小的顺序为Cl->K+>Na+>Al3+,
(3)⑥和高价态的⑤形成的化合物的电子式是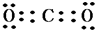 ,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为
,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为 ;用电子式表示元素③和⑨形成化合物的过程
;用电子式表示元素③和⑨形成化合物的过程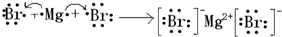
(4)⑥、⑦两种元素形成的简单氢化物中,沸点高的是H2O,原因是水分子之间存在氢键
(5)④和⑧两种元素最高价氧化物对应水化物相互反应的离子方程式3H++Al(OH)3=3H2O+Al3+
(6)写出一个能表示⑦、⑧两种元素非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓,
(7)下列叙述中,肯定a金属比b金属活泼性强的是D(填序号)
A.a原子的最外层电子数比b原子的最外层电子数少
B.a原子的电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1mol b从酸中置换H+生成的H2多
D.常温时,a能从水中置换出氢,而b不能.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ⑨ |
(2)①、②、④、⑧四种元素形成的离子半径由大到小的顺序为Cl->K+>Na+>Al3+,
(3)⑥和高价态的⑤形成的化合物的电子式是
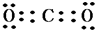 ,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为
,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为 ;用电子式表示元素③和⑨形成化合物的过程
;用电子式表示元素③和⑨形成化合物的过程
(4)⑥、⑦两种元素形成的简单氢化物中,沸点高的是H2O,原因是水分子之间存在氢键
(5)④和⑧两种元素最高价氧化物对应水化物相互反应的离子方程式3H++Al(OH)3=3H2O+Al3+
(6)写出一个能表示⑦、⑧两种元素非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓,
(7)下列叙述中,肯定a金属比b金属活泼性强的是D(填序号)
A.a原子的最外层电子数比b原子的最外层电子数少
B.a原子的电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1mol b从酸中置换H+生成的H2多
D.常温时,a能从水中置换出氢,而b不能.
2. 如图为元素周期表前四周期的一部分,下列 有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列 有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )
 如图为元素周期表前四周期的一部分,下列 有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列 有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )| A. | 常压下5种元素的单质中Z单质的沸 点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | Y元素的非金属性比W元素的非金属性强 | |
| D. | W的氢化物的还原性比Y的氢化物的还原性弱 |
19.反应4X(g)+5Y(g)=4W(g)+6Q(g)在2L的密闭容器中进行,1分钟后,X 减少了0.12mol,则用Y来表示该反应在1分钟内的速率为( )
| A. | 0.06mol/(L•min) | B. | 0.075mol/(L•min) | C. | 0.09mol/(L•min) | D. | 0.12mol/(L•min) |
20.下列物质的水溶液中,因水解呈酸性的是( )
| A. | Na2CO3 | B. | NaHSO4 | C. | HCl | D. | KAl (SO4)2 |