题目内容
3.由盖斯定律结合下述反应方程式,回答问题:(1)NH3(g)+HCl(g)=NH4Cl(s)△H=-176KJ•mol-1
(2)NH3(g)+H2O(l)=NH3•H2O(aq)△H=-35.1KJ•mol-1
(3)HCl(g)+H2O(l)=HCl(aq)△H=-72.3KJ•mol-1
(4)NH3•H2O(aq)+HCl(aq)=NH4Cl(aq)△H=-52.3KJ•mol-1
则NH4Cl(s)+2H2O(l)=NH4Cl(aq)是吸热反应(填“吸热”或“放热”),其反应热的热效应值△H=16.3kJ/mol.
分析 根据盖斯定律(2)+(4)-(1)+(3)得:NH4Cl(s)+2H2O(l)=NH4Cl(aq),据此计算出该反应的焓变,根据计算结果偏大反应吸热还是放热.
解答 解:(1)NH3(g)+HCl(g)=NH4Cl(s)△H=-176kJ/moL
(2)NH3(g)+H2O(l)=NH3﹒H2O(aq)△H=-35.1kJ/moL
(3)HCl(g)+H2O(l)=HCl(aq)△H=-72.3kJ/moL
(4)NH3﹒H2O(aq)+HCl(aq)=NH4Cl(aq)△H=-52.3kJ/moL
根据盖斯定律:(2)+(4)-(1)+(3)得:
NH4Cl(s)+2H2O(l)=NH4Cl(aq)△H=(-35.1kJ•mol-1)+(-52.3kJ•mol-1)-(-176kJ•mol-1)+(-72.3kJ•mol-1)
即NH4Cl(s)+2H2O(l)=NH4Cl(aq)△H=△H=+16.3kJ•mol-1
所以NH4Cl(s)+2H2O(l)=NH4Cl(aq)的反应热是+16.3kJ•mol-1,该反应为吸热反应,
故答案为:吸热; 16.3kJ/mol.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确盖斯定律的内容为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
13.NaOH、KOH等碱溶液可以贮存在下列哪种试剂瓶中( )
| A. |  | B. |  | C. |  | D. |  |
18.下列说法错误的是( )
| A. | 反应产物的总焓与反应物的总焓之差,称为反应焓变 | |
| B. | 反应产物的总焓小于反应物的总焓,该反应为吸收能量反应 | |
| C. | 同一反应在不同温度下进行,其焓变是不同的 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 |
8.根据以下3个热化学方程式:2H2S(g)+3O2(g)→2SO2(g)+2H2O(l)+Q1kJ;2H2S(g)+O2(g)→2S(s)+2H2O(l)+Q2kJ;2H2S(g)+O2(g)→2S(s)+2H2O(g)+Q3kJ.判断Q1、Q2、Q3三者关系正确的是( )
| A. | Q1>Q2>Q3 | B. | Q1>Q3>Q2 | C. | Q3>Q2>Q1 | D. | Q2>Q1>Q3 |
15.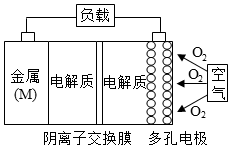 已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )
已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )
 已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )
已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )| A. | 该电池的放电过程的正极反应为O2+4e-+2H2O=4OH- | |
| B. | 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 | |
| C. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极 | |
| D. | 与铝一空气电池相比,镁一空气电池的比能量更高 |
12.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,4.6g乙醇(CH3CH2OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出136.68kJ的热量,试写出表示乙醇燃烧热的热化学方程式:CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8kJ/mol
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键双会释放能量.
已知反应N2(g)+3H2(g)═2NH3(g)△H=akJ•mol-1.
试根据表中所列键能数据计算a的数值:-93
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(石墨,s)+O2(g)═CO2(g)H1=-393.5kJ•mol-1①2H2(g)+O2(g)═2H2O(l)H2=-571.6kJ•mol-1②2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1③
根据盖期定律,计算298K时由C(石墨,s)和H2(g)生成1molC2H2(g)反应的焓变+227.7kJ•mol-.(写出简要的计算过程).
(1)实验测得,4.6g乙醇(CH3CH2OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出136.68kJ的热量,试写出表示乙醇燃烧热的热化学方程式:CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8kJ/mol
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键双会释放能量.
已知反应N2(g)+3H2(g)═2NH3(g)△H=akJ•mol-1.
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ•mol-1) | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(石墨,s)+O2(g)═CO2(g)H1=-393.5kJ•mol-1①2H2(g)+O2(g)═2H2O(l)H2=-571.6kJ•mol-1②2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1③
根据盖期定律,计算298K时由C(石墨,s)和H2(g)生成1molC2H2(g)反应的焓变+227.7kJ•mol-.(写出简要的计算过程).
13. 短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )| A. | 简单离子的半径大小X<Y<Z | |
| B. | 化合物乙中含离子键和非极性共价键 | |
| C. | W与Z形成的化合物常温常压下呈液态 | |
| D. | 图中生成甲的离子方程式为6H++SO32-+2S2-=3S↓+3H2O |