题目内容
13.NaOH、KOH等碱溶液可以贮存在下列哪种试剂瓶中( )| A. |  | B. |  | C. |  | D. |  |
分析 溶液盛放在细口瓶中,且碱溶液与二氧化硅反应生成具有粘合性的硅酸钠,则不能使用玻璃塞,以此来解答.
解答 解:碱可以与玻璃中的SiO2反应,因此碱液只能贮存在带橡胶塞的细口瓶中,A、C中均为玻璃塞,且滴瓶不能长时间保存溶液,
故选B.
点评 本题考查实验装置的应用,为高频考点,把握物质的性质、试剂的保存、实验技能为解答的关键,侧重分析与实验能力的考查,注意二氧化硅的性质,题目难度不大.

练习册系列答案
相关题目
9.运用化学反应原理研究卤族元素单质的有关性质具有重要意义.
(1)从淡化海水中提取溴的流程如下:
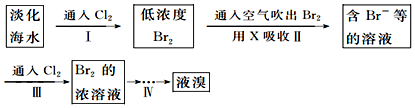
下列有关说法不正确的是C
A.X试剂可用饱和Na2SO3溶液
B.步骤Ⅰ的离子方程式:2Br-+Cl2=2Cl-+Br2
C.工业上每获得1molBr2,需要消耗Cl244.8L
D.步骤Ⅳ包含萃取、分液和蒸馏
(2)ClO2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.下面说法不合理的是D
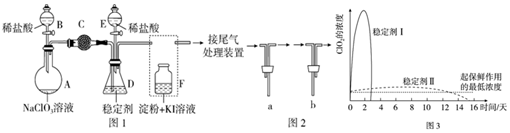
A、打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜慢.
B、关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是吸收Cl2.
C、已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2.在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成
D、已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示.若将其用于水果保鲜,你认为效果较好的稳定剂是稳定剂I,原因是可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.(3)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式NaClO+CO2+H2O═HClO+NaHCO3;2HClO $\frac{\underline{\;关照\;}}{\;}$2HCl+O2↑.若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因ClO-+Cl-+2H+═Cl2↑+H2O.
(4)服用含碘化钾的碘药片可抗核辐射.将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水,蓝色溶液又褪为无色.完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):5Cl2+I2+6H2O=2HIO3+10HCl.
(1)从淡化海水中提取溴的流程如下:

下列有关说法不正确的是C
A.X试剂可用饱和Na2SO3溶液
B.步骤Ⅰ的离子方程式:2Br-+Cl2=2Cl-+Br2
C.工业上每获得1molBr2,需要消耗Cl244.8L
D.步骤Ⅳ包含萃取、分液和蒸馏
(2)ClO2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.下面说法不合理的是D

A、打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜慢.
B、关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是吸收Cl2.
C、已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2.在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成
D、已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示.若将其用于水果保鲜,你认为效果较好的稳定剂是稳定剂I,原因是可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.(3)常温下,已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, |
| K2=5.6×10-11 |
(4)服用含碘化钾的碘药片可抗核辐射.将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水,蓝色溶液又褪为无色.完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):5Cl2+I2+6H2O=2HIO3+10HCl.
10.化学与材料、生活和环境密切相关.下列说法正确的是( )
| A. | 糖、油脂、蛋白质都可以生水解反应 | |
| B. | 天然纤维、聚酚纤维、光导纤维都属于有机高分子材料 | |
| C. | 大力实施矿物燃料脱硫、脱硝技术以减少硫、氮氧化物排放 | |
| D. | 镀锌铁或镀锡铁镀层破损后仍将通过牺牲阳极的阴极保护法防止腐蚀 |
8.用 Zn、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法正确的是( )
| A. | Zn片是正极,Cu片是负极 | B. | 电流方向是从Zn经外电路流向Cu | ||
| C. | 电解液的PH保持不变 | D. | Cu片上有气泡产生 |
18.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 一定温度下,1 L 0.50 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液含NH+4物质的量不同 | |
| B. | 1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 | |
| D. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子. |
5.天然铊有两种稳定同位素,${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl.下列有关铊的同位素说法中,不正确的是( )
| A. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl 质子数相同 | |
| B. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl互为同素异形体 | |
| C. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl中子数之差为2 | |
| D. | ${\;}_{81}^{205}$Tl 原子核内中子数与核外电子数之差为43 |
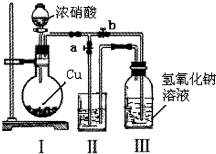 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动: