题目内容
13.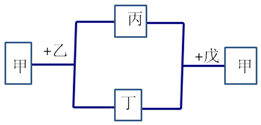 短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )| A. | 简单离子的半径大小X<Y<Z | |
| B. | 化合物乙中含离子键和非极性共价键 | |
| C. | W与Z形成的化合物常温常压下呈液态 | |
| D. | 图中生成甲的离子方程式为6H++SO32-+2S2-=3S↓+3H2O |
分析 甲为元素Z的单质,通常为淡黄色固体,则甲为S单质,Z为S元素,戊为Z的最高价氧化物的水化物,应为硫酸,常温下0.1mol•L-1乙溶液pH为13,应为强碱,则乙为NaOH,与硫反应生成Na2S、Na2SO3,二者在酸性条件下可生成S,短周期元素W、X、Y、Z的原子序数依次增加,且乙、丙、丁、戊为这些元素组成的化合物,由此可知W为H、X为O、Y为Na,以此解答该题.
解答 解:由以上分析可知W为H、X为O、Y为Na、Z为S元素,甲为S单质,乙为NaOH,戊为硫酸,
A.具有相同核外电子排布的离子,核电荷数越大离子半径越小,离子核外电子层数越多,离子半径越大,则简单离子的半径大小Y<X<Z,故A错误;
B.乙为NaOH,含有离子键和极性共价键,故B错误;
C.W与Z形成的化合物为硫化氢,常温常压下呈气态,故C错误;
D.Na2S、Na2SO3在酸性条件下可生成S,离子方程式为6H++SO32-+2S2-=3S↓+3H2O,故D正确.
故选D.
点评 本题考查了无机推断,为高考常见题型和高频考点,题目难度中等,正确推断各物质名称为解答关键,注意熟练掌握硫及其化合物性质,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
相关题目
4.火箭和飞船升空所需的巨大能量可由下列化学反应提供:2N2H4+N2O4═3N2↑+4H2O,有关该反应的说法正确的是( )
| A. | 该反应是分解反应 | B. | 反应中氮元素的化合价降低 | ||
| C. | 氧化剂是N2O4 | D. | 该反应不是氧化还原反应 |
1.分子式为C4H8O2且能与氢氧化钠溶液反应的有机物(不考虑立体异构)有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
8.现有组成为CH4O和C3H8O的混合物,在一定条件下脱水,可能得到的有机产物的种类有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
9.已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4.下列结论正确的是( )
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4.下列结论正确的是( )
| A. | ①②③均是氧化还原反应 | |
| B. | 反应②中氧化剂与还原剂的物质的量之比为1:6 | |
| C. | 氧化性强弱顺序是:K2Cr2O7>I2>Fe2(SO4)3 | |
| D. | 反应③中0.1mol还原剂共失去电子数为0.5NA |
6.(1)下列化学用语均有错误,请将正确的化学用语填在相应的横线上氯元素Cl,2个氮分子2N2,铁离子Fe2+Fe3+
(2)填表:(类别选填“单质”、“氧化物”、“酸”、“碱”、“盐:
(2)填表:(类别选填“单质”、“氧化物”、“酸”、“碱”、“盐:
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
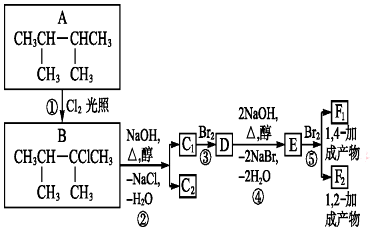
 .
. ;F1的结构简式是
;F1的结构简式是 .
.