题目内容
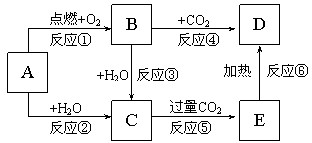 如图所示,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
如图所示,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.填写下列空白:
(1)写出化学式:A
(2)以上反应中属于氧化还原反应的有
(3)写出反应③的化学方程式:
氧化剂是
(4)写出反应②的化学方程式:并用双线桥法标出电子转移方向和数目
(5)写出D溶液中通入CO2的化学方程式:
考点:无机物的推断
专题:推断题
分析:A是一种常见单质,其焰色反应为黄色,则A是Na,B、C、D、E是含A元素的常见化合物,Na在O2中燃烧生成B,B为Na2O2,Na和H2O反应生成NaOH和H2,Na2O2和水反应生成NaOH和O2,所以C是NaOH,NaOH和过量CO2反应生成NaHCO3,所以E是NaHCO3,Na2O2和CO2反应生成Na2CO3和O2,NaHCO3分解生成Na2CO3、CO2和水,所以D是Na2CO3,再结合物质间的反应分析解答.
解答:
解:A是一种常见单质,其焰色反应为黄色,则A是Na,B、C、D、E是含A元素的常见化合物,Na在O2中燃烧生成B,B为Na2O2,Na和H2O反应生成NaOH和H2,Na2O2和水反应生成NaOH和O2,所以C是NaOH,NaOH和过量CO2反应生成NaHCO3,所以E是NaHCO3,Na2O2和CO2反应生成Na2CO3和O2,NaHCO3分解生成Na2CO3、CO2和水,所以D是Na2CO3,
(1)通过以上分析知,A是Na、B是Na2O2,D是Na2CO3,故答案为:Na;Na2O2;Na2CO3;
(2)以上反应中①为钠的燃烧,②为Na与水反应,③为过氧化钠与水反应,④为过氧化钠与二氧化碳反应,均属于氧化还原反应,故答案为:①②③④;
(3)B是过氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,氧化剂是Na2O2氧化产物O2,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;Na2O2;O2;
(4)反应②的离子反应为2Na+2H2O═2Na++2OH-+H2↑,用双线桥法标出电子转移方向和数目为 ,故答案为:
,故答案为: ;
;
(5)Na2CO3溶液中通入CO2的化学方程式为Na2CO3+CO2+H2O=2NaHCO3,故答案为:Na2CO3+CO2+H2O=2NaHCO3.
(1)通过以上分析知,A是Na、B是Na2O2,D是Na2CO3,故答案为:Na;Na2O2;Na2CO3;
(2)以上反应中①为钠的燃烧,②为Na与水反应,③为过氧化钠与水反应,④为过氧化钠与二氧化碳反应,均属于氧化还原反应,故答案为:①②③④;
(3)B是过氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,氧化剂是Na2O2氧化产物O2,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;Na2O2;O2;
(4)反应②的离子反应为2Na+2H2O═2Na++2OH-+H2↑,用双线桥法标出电子转移方向和数目为
 ,故答案为:
,故答案为: ;
;(5)Na2CO3溶液中通入CO2的化学方程式为Na2CO3+CO2+H2O=2NaHCO3,故答案为:Na2CO3+CO2+H2O=2NaHCO3.
点评:本题以钠及其化合物为载体考查了无机物推断,根据焰色反应及A为单质确定A,再结合反应物、反应条件推断物质,注意金属元素化合物知识的积累,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
向一定量的Cu、Fe2O3的混合物中加入100mL 1mol?L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
| A、3.2 g |
| B、2.4 g |
| C、1.6 g |
| D、0.8 g |
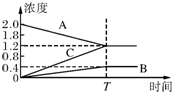 如图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是平衡的时间,能以此曲线表示的反应是( )
如图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是平衡的时间,能以此曲线表示的反应是( )| A、2A?B+3C |
| B、B+3C?2A |
| C、A+C?B |
| D、B?A+C |
已知某温度下CH3COOH和NH3?H2O 的电离常数相等.现向10mL浓度为0.1mol?L?1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,下列说法不正确的是( )
| A、水的电离程度先增大,后又减小 |
| B、c(CH3COOH)与c(CH3COO?)之和始终保持不变 |
| C、溶液导电性先增强后减弱 |
| D、当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO?) |
下列电池工作时,O2在正极放电的是( )
 |  |  |  |
| A.甲醇燃料电池 | B.镍镉电池 | C.锌锰电池 | D.铅蓄电池 |
| A、A | B、B | C、C | D、D |
 试回答下列问题:
试回答下列问题: (8)
(8) (9)CH2=CH-CH3(10)
(9)CH2=CH-CH3(10)