题目内容
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应的化学方程式为
(2)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 .
(1)该反应的化学方程式为
(2)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
考点:氧化还原反应
专题:
分析:由于H2O2发生的变化为H2O2→O2,H2O2为还原剂,则H2CrO4为氧化剂,发生还原反应H2CrO4→Cr(OH)3,发生的化学反应为:2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,结合反应方程式及V=nVm计算.
解答:
解:(1)由H2O2→O2,H2O2为还原剂,则H2CrO4为氧化剂,发生还原反应H2CrO4→Cr(OH)3,由电子及原子守恒可知化学反应为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,故答案为:2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O;
(2)由反应可知,生成3mol气体转移6mol电子,则反应转移了0.3mol电子,则产生的气体在标准状况下体积为0.3mol×
×22.4L/mol=3.36L,
故答案为:3.36L.
(2)由反应可知,生成3mol气体转移6mol电子,则反应转移了0.3mol电子,则产生的气体在标准状况下体积为0.3mol×
| 3 |
| 6 |
故答案为:3.36L.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析、应用、计算能力的考查,题目难度不大.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水电离的少量H+),且SO42-的物质的量浓度为6mol/L,则此溶液最多溶解铁粉的质量为( )
| A、11.2 g |
| B、16.8 g |
| C、19.6 g |
| D、22.4 g |
自然界里常见金属元素存在最多的是铝,其次是铁,铜的含量较少.然而人类冶炼金属获得成功最早的反而是含量少的铜,含量最多的铝最迟冶炼出来,究其原因,合理的是( )
| A、铜矿较易还原,铝矿很难还原 |
| B、铜矿颜色较深,易发现;铝矿颜色较浅,不易发现 |
| C、矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发 |
| D、以上说法都是错误的 |
检验海带中碘元素的实验中,发生如下反应:2H++2I-+H2O2═I2+2H2O,下列对该反应的叙述中不正确的( )
| A、I2为氧化产物 |
| B、H2O2既作氧化剂又作还原剂 |
| C、氧化性强弱顺序为H2O2>I2 |
| D、生成1 mol I2时转移2 mol电子 |
下列说法中错误的是( )
| A、从2L1mol?L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol?L-1 |
| B、制成0.5L 1 mol?L-1的盐酸,需标准状况下氯化氢气体11.2 L |
| C、1L1mol?L-1 BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 |
| D、10g98%硫酸(密度为1.84g?cm-3)与10mL 18.4 mol?L-1硫酸的浓度是不同的 |
下列物质,属于强电解质的( )
| A、NH3?H2O |
| B、H2O |
| C、NaHCO3 |
| D、NaOH溶液 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- |
| B、常温下的溶液:KW/c(H+)=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- |
| C、稀硫酸中:K+、Mg2+、AlO2-、S2O32- |
| D、加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
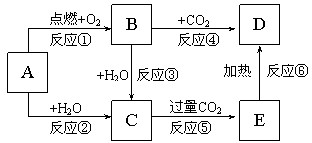 如图所示,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
如图所示,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.