题目内容
A.下图所示为血红蛋白和肌红蛋白的活性部分--血红素的结构式.

回答下列问题:
(1)血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ,写出基态Fe原子的核外电子排布式 .
(2)血红素中N原子的杂化方式为 ,在下图的方框内用“→”标出Fe2+的配位键.
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 .

B.我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
实验中涉及的部分反应:
M2+(金属离子)+EBT(铬黑T)=M EBT
蓝色 酒红色
M2+(金属离子)+Y4-(EDTA)=MY2-
MEBT+Y4-(EDTA)=MY2-+EBT(铬黑T)
(1)取地下水样品25.0毫升进行预处理.已知水中由Ca2+、Mg2+和HCO3-所引起的硬度称为暂时硬度,可通过加热减小硬度,写出加热时所发生的化学反应(任写一个) .预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是 .
(2)将处理后的水样转移到250mL的锥形瓶中,加入氨水-氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.0100mol?L-1的EDTA标准溶液进行滴定,滴定时眼睛应 ,滴定终点时的实验现象是 .
(3)滴定终点时共消耗EDTA溶液15.0mL,则该地下水的硬度= .
(4)若实验时装有EDTA标准液的滴定管只用蒸馏水润洗而未用标准液润洗,则测定结果将 (填“偏大”、“偏小”或“无影响”).

回答下列问题:
(1)血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是
(2)血红素中N原子的杂化方式为

(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为

B.我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
实验中涉及的部分反应:
M2+(金属离子)+EBT(铬黑T)=M EBT
蓝色 酒红色
M2+(金属离子)+Y4-(EDTA)=MY2-
MEBT+Y4-(EDTA)=MY2-+EBT(铬黑T)
(1)取地下水样品25.0毫升进行预处理.已知水中由Ca2+、Mg2+和HCO3-所引起的硬度称为暂时硬度,可通过加热减小硬度,写出加热时所发生的化学反应(任写一个)
(2)将处理后的水样转移到250mL的锥形瓶中,加入氨水-氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.0100mol?L-1的EDTA标准溶液进行滴定,滴定时眼睛应
(3)滴定终点时共消耗EDTA溶液15.0mL,则该地下水的硬度=
(4)若实验时装有EDTA标准液的滴定管只用蒸馏水润洗而未用标准液润洗,则测定结果将
考点:晶胞的计算,元素电离能、电负性的含义及应用,配合物的成键情况,原子轨道杂化方式及杂化类型判断,中和滴定
专题:化学键与晶体结构
分析:A.(1)根据第一电离能递变规律得到答案;根据Fe原子序数写出核外电子排布式;
(2)根据N原子形成的共价键类型判断杂化类型;能够提供孤对电子的原子指向提供空轨道的原子;
(3)根据Fe原子所在位置用均摊法计算;根据堆积类型判断配位数;
B、(1)根据水中存在的离子来判断;煮沸是为了降低水中气体的溶解度;
(2)滴定终点通过颜色的变化来判断;防止滴定过量和滴定不足;
(3)根据题目信息先计算出CaO的物质的量,再求出CaO的物质的质量,然后求出水的硬度;
(4)未用标准液润洗导致标准液浓度降低,由此判断误差.
(2)根据N原子形成的共价键类型判断杂化类型;能够提供孤对电子的原子指向提供空轨道的原子;
(3)根据Fe原子所在位置用均摊法计算;根据堆积类型判断配位数;
B、(1)根据水中存在的离子来判断;煮沸是为了降低水中气体的溶解度;
(2)滴定终点通过颜色的变化来判断;防止滴定过量和滴定不足;
(3)根据题目信息先计算出CaO的物质的量,再求出CaO的物质的质量,然后求出水的硬度;
(4)未用标准液润洗导致标准液浓度降低,由此判断误差.
解答:
解:A.(1)同周期第一电离能呈增大趋势,由于第ⅤA族p轨道半充满,较为稳定,第一电离能大于第ⅥA族,故第一电离能C<O<N;Fe原子序数为26,根据能量最低原则、泡利不相容原理和洪特规则写出核外电子排布式,内层电子排列与Ar完全相同,电子排布式为[Ar]3d64S2,
故答案为:C<O<N、[Ar]3d64s2;
(2)形成双键的N原子空间构型为平面,所以以sp2杂化,形成单键的N原子,与NH3杂化相同,可知,以sp3杂化;N原子最外层有5个电子,只需要形成3条键即可达到稳定结构,但是图中形成双键的N原子形成了四条键,显然有一条为配位键,可表示为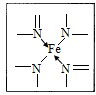 ,故答案为:sp2、sp3、
,故答案为:sp2、sp3、
(3)γ-Fe原子中8个位于顶点,6个位于面心,利用均摊法计算:8×
+6×
=4;δ-Fe为体心立方,配位数为8,α-Fe为简单立方,配位数为6,其配位数之比为8:6=4:3,故答案为:4、4:3;
B.(1)溶液存在HCO3-与Ca2+、Mg2+组成化合物加热容易分解,生成碳酸盐,二氧化碳和水,可写出化学方程式;加入浓盐酸可以是溶液中的HCO3-生成CO2,为了防止溶解的CO2的干扰应除去,所以要煮沸,方程式为Ca(HCO3)2
CaCO3↓+CO2↑+H2O或Mg(HCO3)2
MgCO3↓+CO2↑+H2O,
故答案为:Ca(HCO3)2
CaCO3↓+CO2↑+H2O或Mg(HCO3)2
MgCO3↓+CO2↑+H2O;除去溶解的CO2.
(2)滴定终点是通过指示剂颜色变化来确定的,为了准确判断滴定终点,眼睛必须注视溶液颜色变化;接近滴定终点时,溶液会有颜色变化,充分震荡后颜色又恢复原样,所以在判断终点时必须在一定时间内颜色不恢复原色,
故答案为:注视锥形瓶中溶液颜色的变化、溶液由酒红色变为蓝色且半分钟不褪色;
(3)25.0毫升水中含Ca2+和Mg2+的总物质的量等于EDTA的物质的量=0.0100mol/L×0.015L=1.5×10-4mol,折合成CaO的质量为1.50×10-4mol×56g/mol=8.40×10-3g,所以水的硬度为
×
=33.6度,
故答案为:33.6度;
(4)未用标准液润洗,则加入标准液后浓度偏低,则滴定需要的标准液体积增大,计算时误差偏大,故答案为:偏大.
故答案为:C<O<N、[Ar]3d64s2;
(2)形成双键的N原子空间构型为平面,所以以sp2杂化,形成单键的N原子,与NH3杂化相同,可知,以sp3杂化;N原子最外层有5个电子,只需要形成3条键即可达到稳定结构,但是图中形成双键的N原子形成了四条键,显然有一条为配位键,可表示为
 ,故答案为:sp2、sp3、
,故答案为:sp2、sp3、
(3)γ-Fe原子中8个位于顶点,6个位于面心,利用均摊法计算:8×
| 1 |
| 8 |
| 1 |
| 2 |
B.(1)溶液存在HCO3-与Ca2+、Mg2+组成化合物加热容易分解,生成碳酸盐,二氧化碳和水,可写出化学方程式;加入浓盐酸可以是溶液中的HCO3-生成CO2,为了防止溶解的CO2的干扰应除去,所以要煮沸,方程式为Ca(HCO3)2
| ||
| ||
故答案为:Ca(HCO3)2
| ||
| ||
(2)滴定终点是通过指示剂颜色变化来确定的,为了准确判断滴定终点,眼睛必须注视溶液颜色变化;接近滴定终点时,溶液会有颜色变化,充分震荡后颜色又恢复原样,所以在判断终点时必须在一定时间内颜色不恢复原色,
故答案为:注视锥形瓶中溶液颜色的变化、溶液由酒红色变为蓝色且半分钟不褪色;
(3)25.0毫升水中含Ca2+和Mg2+的总物质的量等于EDTA的物质的量=0.0100mol/L×0.015L=1.5×10-4mol,折合成CaO的质量为1.50×10-4mol×56g/mol=8.40×10-3g,所以水的硬度为
| 8.40×10-3g |
| 10mg |
| 1L |
| 25mL |
故答案为:33.6度;
(4)未用标准液润洗,则加入标准液后浓度偏低,则滴定需要的标准液体积增大,计算时误差偏大,故答案为:偏大.
点评:本题主要考查本题考查物质结构与性质,涉及元素周期表、元素周期律、杂化理论、化学键、分子结构与性质、晶胞计算,硬水、新信息处理能力,解题的关键是掌握对新信息处理能力.

练习册系列答案
相关题目
对于反应C(s)+H2O(g)?CO(g)+H2(g);△H>0,下列有关说法正确的是( )
A、平衡常数表达式为K=
| ||
| B、增大体系压强,平衡常数K不发生变化 | ||
| C、升高体系温度,平衡常数K减小 | ||
| D、增加C(s)的量,平衡正向移动 |
下列离子方程式的书写正确的是( )
| A、实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O |
| B、铁和稀硫酸反应:Fe+2H+═H2↑+Fe3+ |
| C、NH4HCO3溶液中加入过量的NaOH溶液:NH4++OH-═NH3+H2O |
| D、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O |



 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2