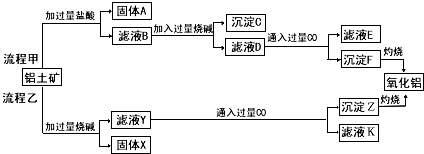
题目内容
孔雀石主要含Cu 2(OH)2CO3,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4?5H2O及纳米材料G,步骤如下:
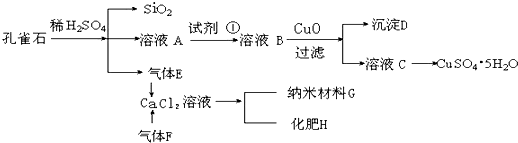
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+.从下列所给试剂中选择:实验步骤中试剂①最佳为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号).
a.KMnO4/H+b.Cl2 c.H2O2 d.KSCN
(2)沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为 .加入CuO作用是 .
(3)由溶液C获得CuSO4?5H2O,需要经过 操作.
(4)除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 .
(5)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入) (填化学式),写出该反应的化学方程式 .
(6)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用 .取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 .

(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+.从下列所给试剂中选择:实验步骤中试剂①最佳为
a.KMnO4/H+b.Cl2 c.H2O2 d.KSCN
(2)沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为
(3)由溶液C获得CuSO4?5H2O,需要经过
(4)除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是
(5)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入)
(6)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:孔雀石加入稀硫酸,生成气体E为二氧化碳,溶液A中含有Cu2+、Fe2+、Fe3+,加入试剂①将Fe2+氧化为Fe3+,加入试剂能达到实验目的,又不引入新杂质,一般为H2O2,然后加入CuO调节溶液pH,可使铁离子水解生成Fe(OH)3,即D为Fe(OH)3,溶液C含有硫酸铜,经蒸发结晶可得到CuSO4?5H2O,在氯化钙溶液中通入二氧化碳和氨气,可生成碳酸钙纳米材料,同时生成氯化铵,以此解答该题.
解答:
解:孔雀石加入稀硫酸,生成气体E为二氧化碳,溶液A中含有Cu2+、Fe2+、Fe3+,加入试剂①将Fe2+氧化为Fe3+,加入试剂能达到实验目的,又不引入新杂质,一般为H2O2,然后加入CuO调节溶液pH,可使铁离子水解生成Fe(OH)3,即D为Fe(OH)3,溶液C含有硫酸铜,经蒸发结晶可得到CuSO4?5H2O,在氯化钙溶液中通入二氧化碳和氨气,可生成碳酸钙纳米材料,同时生成氯化铵,
(1)选择“最佳试剂”,是加入试剂能达到实验目的,又不引入新杂质.溶液A的金属离子有Cu2+、Fe2+、Fe3+,溶液A加入试剂①将Fe2+氧化为Fe3+,若a.加入高锰酸钾,引入K+、Mn2+等,故a错误;
b.若加入氯气,会引入氯离子,故b错误;
c.加入双氧水,双氧水是一种绿色试剂,将Fe2+氧化为Fe3+,不会引入杂质,故c正确;
d.若加入KSCN溶液,不能氧化亚铁离子,故d错误,
检验溶液中Fe3+,使用的试剂是KSCN溶液,溶液变成血红色,是Fe3+的特征反应,
故答案为:c;d;
(2)溶液B加入CuO调节溶液pH值,使Fe3+的水解生成氢氧化铁沉淀而除去,淀D中除了过量的CuO外,还含有Fe(OH)3,
故答案为:Fe(OH)3;调节溶液的pH,促进Fe3+的水解;
(3)由溶液制得晶体,应进行蒸发、冷却结晶、过滤等操作,故答案为:蒸发、冷却结晶、过滤;
(4)过滤操作一般要用到三种玻璃仪器:烧杯、漏斗、玻璃棒.玻璃棒的作用是引流,避免液体外溅,故答案为:引流;
(5)根据流程图知,生成的气体F为二氧化碳,在氯化钙溶液中通入氨气、二氧化碳制备碳酸钙纳米材料.因为二氧化碳不与氯化钙溶液反应,同时二氧化碳在水中的溶解度很小,因此,要先向氯化钙溶液中加入氨水或通入氨气,在碱性溶液中通入二氧化碳,增加二氧化碳的溶解度,从而生成碳酸钙,反应方程式为:2NH3+CO2+CaCl2+H2O=CaCO3↓+2NH4Cl,
故答案为:NH3;2NH3+CO2+H2O+CaCl2→CaCO3↓+2NH4Cl;
(6)酸性高锰酸钾溶液具有强氧化性,碱式滴定管下端有一段橡胶管,橡胶管能被酸性高锰酸钾氧化,故应选择酸式滴定管;
滴定时滴入最后一滴,高锰酸钾不反应,溶液变成紫红色并保持半分钟说明滴定到达终点,
故答案为:酸式滴定管;溶液变成紫红色且半分钟不变化.
(1)选择“最佳试剂”,是加入试剂能达到实验目的,又不引入新杂质.溶液A的金属离子有Cu2+、Fe2+、Fe3+,溶液A加入试剂①将Fe2+氧化为Fe3+,若a.加入高锰酸钾,引入K+、Mn2+等,故a错误;
b.若加入氯气,会引入氯离子,故b错误;
c.加入双氧水,双氧水是一种绿色试剂,将Fe2+氧化为Fe3+,不会引入杂质,故c正确;
d.若加入KSCN溶液,不能氧化亚铁离子,故d错误,
检验溶液中Fe3+,使用的试剂是KSCN溶液,溶液变成血红色,是Fe3+的特征反应,
故答案为:c;d;
(2)溶液B加入CuO调节溶液pH值,使Fe3+的水解生成氢氧化铁沉淀而除去,淀D中除了过量的CuO外,还含有Fe(OH)3,
故答案为:Fe(OH)3;调节溶液的pH,促进Fe3+的水解;
(3)由溶液制得晶体,应进行蒸发、冷却结晶、过滤等操作,故答案为:蒸发、冷却结晶、过滤;
(4)过滤操作一般要用到三种玻璃仪器:烧杯、漏斗、玻璃棒.玻璃棒的作用是引流,避免液体外溅,故答案为:引流;
(5)根据流程图知,生成的气体F为二氧化碳,在氯化钙溶液中通入氨气、二氧化碳制备碳酸钙纳米材料.因为二氧化碳不与氯化钙溶液反应,同时二氧化碳在水中的溶解度很小,因此,要先向氯化钙溶液中加入氨水或通入氨气,在碱性溶液中通入二氧化碳,增加二氧化碳的溶解度,从而生成碳酸钙,反应方程式为:2NH3+CO2+CaCl2+H2O=CaCO3↓+2NH4Cl,
故答案为:NH3;2NH3+CO2+H2O+CaCl2→CaCO3↓+2NH4Cl;
(6)酸性高锰酸钾溶液具有强氧化性,碱式滴定管下端有一段橡胶管,橡胶管能被酸性高锰酸钾氧化,故应选择酸式滴定管;
滴定时滴入最后一滴,高锰酸钾不反应,溶液变成紫红色并保持半分钟说明滴定到达终点,
故答案为:酸式滴定管;溶液变成紫红色且半分钟不变化.
点评:本题以化学工艺流程图为载体,设计方案制备重要化学试剂蓝矾和碳酸钙纳米材料,考查无机化学与实验的融合能力,以及完成基本实验操作的能力.

练习册系列答案
相关题目
 反应mX(g)?nY(g)+pZ(g)△H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示.下列说法错误的是( )
反应mX(g)?nY(g)+pZ(g)△H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示.下列说法错误的是( )| A、该反应的△H>O |
| B、m<n+p |
| C、B、C两点化学平衡常数:KB>KC |
| D、A、C两点的反应速率v(A)<v(C) |
把表面有少量氧化物的铜片和铁片一起放入足量盐酸中充分反应,在该溶液中的金属离子是( )
| A、只有Fe2+ |
| B、Fe3+和Cu2+ |
| C、Fe2+ 和Cu2+ |
| D、Fe3+和Fe2+ |