题目内容
将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应.求:
(1)所用盐酸中HCl的物质的量浓度c(HCl)= ;
(2)反应中生成的H2在标准状况下的体积V(H2)= .
(1)所用盐酸中HCl的物质的量浓度c(HCl)=
(2)反应中生成的H2在标准状况下的体积V(H2)=
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据锌与盐酸恰好完全反应,将锌的物质的量代入锌与盐酸反应的化学方程式可计算HCl的物质的量,然后求出浓度;
(2)根据锌与盐酸恰好完全反应,将锌的物质的量代入锌与盐酸反应的化学方程式可计算氢气的物质的量,然后计算氢气在标准状况下的体积.
(2)根据锌与盐酸恰好完全反应,将锌的物质的量代入锌与盐酸反应的化学方程式可计算氢气的物质的量,然后计算氢气在标准状况下的体积.
解答:
解:(1)锌的物质的量为
=0.1mol,
设反应的HCl为xmol,则
Zn+2HCl═ZnCl2+H2↑
1 2
0.1mol x
所以x=0.2mol,则c(HCl)=
=
=1mol/L;
故答案为:1mol/L;
(2)设生成氢气的物质的量为y,则
Zn+2HCl═ZnCl2+H2↑
1 1
0.1mol y
解得y=0.1mol,
生成标准状况下的H2的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24L.
| 6.5g |
| 65g/mol |
设反应的HCl为xmol,则
Zn+2HCl═ZnCl2+H2↑
1 2
0.1mol x
所以x=0.2mol,则c(HCl)=
| n |
| V |
| 0.2mol |
| 0.2L |
故答案为:1mol/L;
(2)设生成氢气的物质的量为y,则
Zn+2HCl═ZnCl2+H2↑
1 1
0.1mol y
解得y=0.1mol,
生成标准状况下的H2的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24L.
点评:本题考查学生利用化学反应方程式的计算,明确锌的量代入化学反应方程式是计算的关键,题目难度不大.

练习册系列答案
相关题目
下列关于元素及其化合物的说法正确的是( )
| A、Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应 |
| B、Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同 |
| C、在稀硫酸中加入铜粉,铜粉不溶解,若再继续加入KNO3固体,铜粉会溶解 |
| D、金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱 |
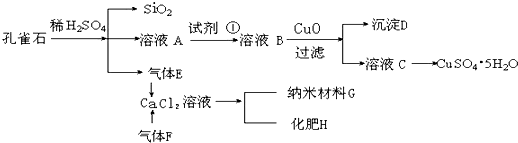

 298K时,某容积固定为1L的密闭容器中加入0.5mol A发生如下可逆反应:A(g)═2B(g)△H=a kJ?mol-1.其中B的物质的量浓度随时间变化如图.
298K时,某容积固定为1L的密闭容器中加入0.5mol A发生如下可逆反应:A(g)═2B(g)△H=a kJ?mol-1.其中B的物质的量浓度随时间变化如图.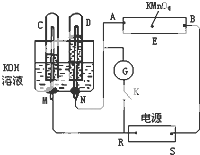 如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示.
如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示. ,这是一种值得进一步研究应用的药物.
,这是一种值得进一步研究应用的药物.