题目内容
在体积都为1L、pH都等于2的盐酸和醋酸溶液中,分别投入等量的锌粒,则下图所示比较符合客观事实的是( )
A、 |
B、 |
C、 |
D、 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:根据盐酸和醋酸溶液中的氢离子物质的量和加入锌的物质的量,依据盐酸是强酸,醋酸是弱酸存在电离平衡判断反应过程和反应量的关系,结合图象中的纵坐标和横坐标的意义,曲线的变化趋势,起点、拐点、终点的意义分析判断是否符合事实.
解答:
解:体积都为1L,pH都等于2的盐酸和醋酸溶液中,n(CH3COOH)>n(HCl)=0.01mol,锌和酸反应Zn+2H+=Zn2++H2↑,盐酸酸溶液中氢离子不足,醋酸溶液中存在电离平衡,平衡状态下的氢离子不足,但随着反应进行,醋酸又电离出氢离子进行反应,放出的氢气一定比盐酸多,开始时由于氢离子浓度相同,开始的反应速率相同,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以反应速率快;反应后,醋酸有剩余,导致醋酸溶液中pH小于盐酸溶液中;
A.由于醋酸会不断电离出H+,因此醋酸pH上升会比盐酸慢.虽然和同量的Zn反应,醋酸速率快,但是这是pH,不是氢气的量,所以pH上升醋酸慢,故A错误;
B.反应开始氢离子浓度相同,反应速率相同.曲线从相同速率开始反应,但醋酸溶液中存在电离平衡,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以醋酸溶液反应过程中反应速率快,溶解的锌的量也比盐酸多,所以图象不符合题意,故B错误;
C.产生氢气的量从0开始逐渐增多,最终由于醋酸电离平衡的存在,生成氢气的量比盐酸多,反应过程中氢离子浓度大于盐酸溶液中氢离子浓度,和同量锌反应速率快,若Zn少量产生的H2的量相同,锌过量则醋酸产生的氢气多,故图象符合Zn少量,故C正确;
D.如果Zn过量,生成的醋酸锌和氯化锌,前者双水解,后者Zn离子水解,因此前者的酸性会比后者的弱,氢离子浓度自然是前者小于后者,故D正确;
故选CD.
A.由于醋酸会不断电离出H+,因此醋酸pH上升会比盐酸慢.虽然和同量的Zn反应,醋酸速率快,但是这是pH,不是氢气的量,所以pH上升醋酸慢,故A错误;
B.反应开始氢离子浓度相同,反应速率相同.曲线从相同速率开始反应,但醋酸溶液中存在电离平衡,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以醋酸溶液反应过程中反应速率快,溶解的锌的量也比盐酸多,所以图象不符合题意,故B错误;
C.产生氢气的量从0开始逐渐增多,最终由于醋酸电离平衡的存在,生成氢气的量比盐酸多,反应过程中氢离子浓度大于盐酸溶液中氢离子浓度,和同量锌反应速率快,若Zn少量产生的H2的量相同,锌过量则醋酸产生的氢气多,故图象符合Zn少量,故C正确;
D.如果Zn过量,生成的醋酸锌和氯化锌,前者双水解,后者Zn离子水解,因此前者的酸性会比后者的弱,氢离子浓度自然是前者小于后者,故D正确;
故选CD.
点评:本题考查了化学反应速率的影响条件,弱电解质的电离平衡的应用,图象分析方法,关键是反应过程中溶液中的氢离子浓度大小的判断和一定量锌与氢离子反应的过量判断,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、标况下,11.2L SO3所含的分子数目为0.5 NA |
| B、室温下,1L pH=1的稀硫酸溶液中,由水电离的H+离子数目为0.2NA |
| C、铅蓄电池放电时,正极消耗4mol H+,则电路中通过的电子数目为2NA |
| D、8 Al+3 NH4ClO4═4 Al2O3+3NH3+3HCl 反应中,消耗27gAl粉时,转移的电子数目为2.75NA(Al原子量-27) |
单质X能从含有Y的盐溶液中置换出单质Y,由此可知( )
| A、当Y是金属时,X可能是金属,也可能是非金属 |
| B、当X、Y都是非金属时,Y的非金属性一定比X强 |
| C、当X、Y都是金属时,Y的金属性一定比X强 |
| D、当Y是非金属时,X可能是金属也可能是非金属 |
 现有MgO和Al2O3的固体混合物,向其中加入100mL 2moL?L-1稀盐酸,充分反应后向溶液中逐滴加入 1moL?L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:
现有MgO和Al2O3的固体混合物,向其中加入100mL 2moL?L-1稀盐酸,充分反应后向溶液中逐滴加入 1moL?L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图: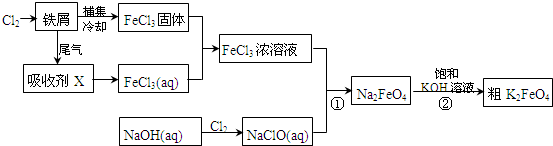
 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题: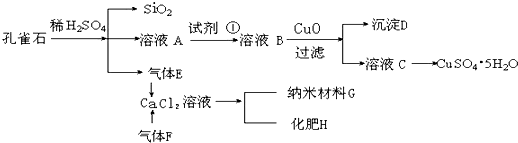
 如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示.
如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示.