题目内容
2.在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应(填“吸热”或“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是BC(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(3)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和xmolH2,则:
①当x=5.0时,上述平衡向逆反应(填“正反应”、“逆反应”、“恰好平衡”)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是0≤x<3.
(4)在850℃时,若设x=5.0mol和x=6.0mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a< b (填“>”、“<”或“=”).
分析 (1)由表中数据可知升高温度,平衡常数增大,说明平衡正向移动;
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,以此判断;
(3)①求出此时的浓度商Qc,与平衡常数相比,判断平衡移动方向;
②用x表示出浓度商Qc,平衡向正反应方向移动,浓度商小于平衡常数;
(4)增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,故平衡后氢气的体积分数还是大于原来的.
解答 解:(1)由表中数据可知升高温度,平衡常数增大,说明平衡正向移动,则正反应为吸热反应,故答案为:吸热;
(2)A.由于反应前后体积不变,则压强不变,无论是否达到平衡状态,都存在容器中压强不变,不能用于判断是否达到平衡状态,故A错误;
B.混合气体中 c(CO)不变,可说明正逆反应速率相等,达到平衡状态,故B正确;
C.υ正(H2)=υ逆(H2O),说明正逆反应速率相等,达到平衡状态,故C正确;
D.反应速率之比等于化学计量数之比,c(CO2)=c(CO)不能说明达到平衡状态,故D错误.
故答案为:BC;
(3)①此时的浓度商Qc=$\frac{5×1}{1×3}$=1.67,大于平衡常数1,故平衡向逆反应方向移动,故答案为:逆反应;
②平衡向正反应方向移动,浓度商小于平衡常数,即$\frac{1×x}{1×3}$<1,解得0≤x<3,故答案为:0≤x<3;
(4)加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为a%<b%,故答案为:<.
点评 本题考查了化学平衡常数计算分析判断以及平衡移动温度,为高频考点,侧重于学生的分析能力和计算能力的考查,注意化学平衡常数只与温度有关,与反应物浓度、是否使用催化剂无关,温度不变,化学平衡常数不变,注重知识的迁移应用,题目难度中等.

①滴入几滴浓盐酸
②加NaCl溶液
③滴入几滴硫酸铜溶液
④升高温度(不考虑盐酸挥发)
⑤改用 19.6mol/L的硫酸溶液.
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
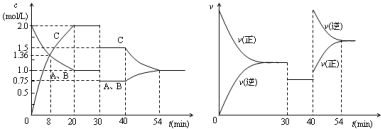
| A. | 30min时降低温度,40min时升高温度 | |
| B. | 8min前A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为放热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
| A. | (m+n)必定小于 p | B. | (m+n)必定大于 p | C. | m 必定小于 p | D. | n 必定大于 p |
| A. | 含有NA个NO2、N2O4分子的混合气体降低温度,混合气体的分子数目小于NA | |
| B. | 常温常压和光照条件下,33.6 LCl2与3.0g H2反应,生成的HCl分子数目为3NA | |
| C. | 1.68 g Fe和足量水蒸气反应,转移的电子数目为0.09NA | |
| D. | 一定条件下,1 mol N2和3 mol H2充分反应,生成物中含N-H键数目为6NA |
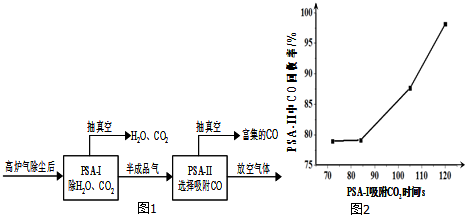

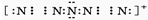 .
.