题目内容
7.氢氧燃料电池已用于航天飞船.电池反应产生的水经冷凝后可作为航天员的饮用水,其电极反应如下:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-当得到1.8L饮用水时,电池内转移电子数约为( )| A. | 1.8 mol | B. | 3.6 mol | C. | 100 mol | D. | 200 mol |
分析 先根据电极反应式写出电池反应式,负极:2H2-4e-+4OH-=4H2O;正极:O2+2H2O+4e-=4OH-,根据电池反应式中水和转移电子的关系计算.
解答 解:1.8L水的质量为1800g,水的物质的量为n=$\frac{m}{M}$=$\frac{1800g}{18g/mol}$=100mol,
负极:2H2-4e-+4OH-=4H2O ①
正极:O2+2H2O+4e-=4OH-②
①+②得:2H2+O2=2H2O 转移电子
2mol 4mol
100mol 200mol
故答案为,200mol.
故选D.
点评 本题考查了常见化学电源及氧化还原反应的有关计算,能正确书写电极方程式并根据电子转移情况作计算,题目较简单.

练习册系列答案
相关题目
17.以下实验能获得成功的是( )
| A. | 用酸性KMnO4溶液鉴别乙烯和乙炔 | |
| B. | 将铁屑、溴水、苯混合制成溴苯 | |
| C. | 蔗糖溶液加稀H2SO4加热后再加新制银氨溶液制银镜 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
18.已知:Mg2Si+4HCl═SiH4↑+2MgCl2,下列说法正确的是( )
| A. | 原子半径:Si>Mg | B. | 氢元素不存在同位素 | ||
| C. | 该反应熵增 | D. | SiH4比HCl稳定 |
16.有M、R两种主族元素,已知M2-离子与R+离子核外电子数之和为20,下列说法正确的是( )
| A. | M与R的质子数之和一定等于21 | B. | 若M在第3周期,则R一定在第2周期 | ||
| C. | M2-可能比R+的离子半径小 | D. | M与R的原子序数之差可能等于7 |
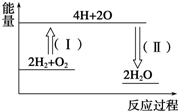 氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1,请回答下列问题:
氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1,请回答下列问题: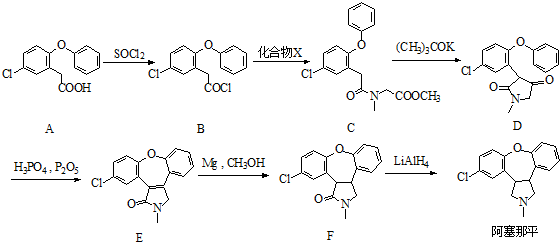
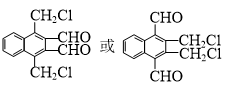 .
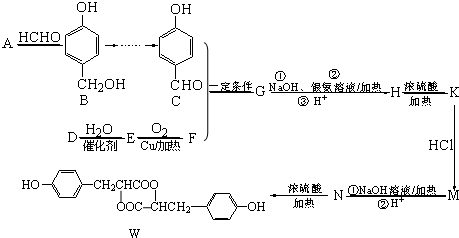
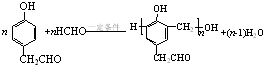
. )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;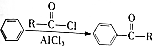 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和 为原料制备
为原料制备 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示: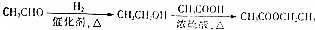

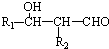
 .
.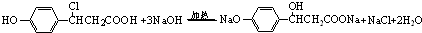 .
. .
.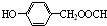 .
.