题目内容
15.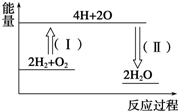 氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1,请回答下列问题:
氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1,请回答下列问题:①若2mol氢气完全燃烧生成水蒸气,则放出的热量小于(填“大于”、“小于”或“等于”)572kJ.
②反应2H2+O2═2H2O的能量变化如图所示.已知拆开1mol H2、1mol O2和1mol H-O中的化学键分别需要消耗436kJ、496kJ和463kJ能量,则反应过程(Ⅱ)放出(填“吸收”或“放出”)1852kJ能量.
分析 ①液态水变成水蒸气需要吸热;
②形成化学键放出能量,反应过程(Ⅱ)代表形成了2mol水,即4molH-O放出的能量.
解答 解:①由2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1可知,2mol氢气完全燃烧生成液态水时放出572kJ的热量,液态水变成水蒸气需要吸热,所以若2mol氢气完全燃烧生成水蒸气,则放出的热量小于572kJ,
故答案为:小于;
②形成化学键放出能量,反应过程(Ⅱ)代表形成了2mol水,即4molH-O放出的能量,因此放出能量为4×463kJ=1852kJ,
故答案为:放出;1852.
点评 本题考查化学反应与能量变化,明确热化学方程式的意义和反应热与键能的关系是解题的关键,题目难度中等.

练习册系列答案
相关题目
5.下列有关叙述正确的是( )
| A. | 煤经过分馏可得到焦炭、煤焦油和焦炉气 | |
| B. | 石油裂化是为了获得更多的汽油 | |
| C. | 医用酒精的浓度通常为95% | |
| D. | 甲烷、汽油、酒精都是可燃性烃,都可作燃料 |
6.下列方法可以加快铁和稀硫酸的反应速率的是( )
| A. | 加入少量ZnCl2固体 | B. | 加入少量CuSO4固体 | ||
| C. | 加入少量水 | D. | 用98%的浓硫酸代替稀硫酸 |
3.锂空气电池充放电基本原理如图所示,下列说法不正确的是( )
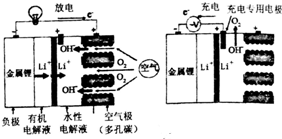

| A. | 充电时,锂离子向阴极移动 | |
| B. | 充电时阴极电极反应式为:Li++e-═Li | |
| C. | 放电时正极电极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 负极区的有机电解液可以换成水性电解液 |
20.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| C. | 0.1mol•L-1Na2CO3与0.05mol•L-1NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |
7.氢氧燃料电池已用于航天飞船.电池反应产生的水经冷凝后可作为航天员的饮用水,其电极反应如下:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-当得到1.8L饮用水时,电池内转移电子数约为( )
| A. | 1.8 mol | B. | 3.6 mol | C. | 100 mol | D. | 200 mol |
4.下列实验中,所采取的实验方法(或操作)与对应的原理都正确的是( )
| 选项 | 实验 | 方法(或操作) | 原理 |
| A | 分离溶于水中的溴 | 植物油萃取 | 溴在植物油中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 从蛋清中提取蛋白质 | 加入硫酸铜溶液 | 浓盐溶液使蛋白质溶解度降低 |
| D | 尿液中尿糖的检验 | 加入新制Cu(OH)2、加热 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
3.氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示.
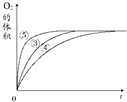 分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2L固定容积的密闭容
器中,5min后反应达平衡时,n(N2)=1.2mol,n(H2)=1.2mol,n(NH3)=0.8mol,则反应速率v(N2)=0.04mol/(L•mim),平衡常数=1.23(mol/L)-2(保留两位小数).若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡向右(填向左、向右或不移动)移动.
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol/L的硫酸,10s时收集产生的H2体积为50mL(若折合成标准状况下的H2体积为44.8mL),用锌粒来表示10s内该反应的速率为0.013g/s;
(2)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是C(填序号).
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示.
 分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.Ⅱ.若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2L固定容积的密闭容
器中,5min后反应达平衡时,n(N2)=1.2mol,n(H2)=1.2mol,n(NH3)=0.8mol,则反应速率v(N2)=0.04mol/(L•mim),平衡常数=1.23(mol/L)-2(保留两位小数).若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡向右(填向左、向右或不移动)移动.
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol/L的硫酸,10s时收集产生的H2体积为50mL(若折合成标准状况下的H2体积为44.8mL),用锌粒来表示10s内该反应的速率为0.013g/s;
(2)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是C(填序号).
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.