题目内容
18.已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题: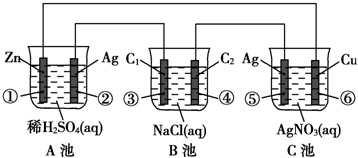
(1)各装置名称是:A池原电池,B池电解池.
(2)写出电极上发生的反应:①Zn-2e-═Zn2+,③2Cl--2e-═Cl2↑,⑤Ag-e-═Ag+.
(3)当电路上有2mol电子流过时,①极上质量变化65g,⑥极上质量变化216g.
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是C.
分析 (1)金属活动相差越大,形成原电池时越容易放电,在串联电路中充当电源,则A池为原电池,B、C为电解池;
(2)①为负极,②为正极,负极发生氧化反应,Zn失去电子生成Zn2+;
③连接电源正极,为阳极,发生氧化反应,氯离子放电生成氯气;
⑤连接电源正极,为阳极,发生氧化反应,银放电生成银离子;
(3)根据电子转移守恒计算Zn的物质的量,进而计算参加反应Zn的质量;
⑥为阴极,发生反应:Ag++e-═Ag,根据电子转移守恒计算Ag的质量;
(4)A、B、C三池中C为电镀池,电解质溶液浓度不变.
解答 解:(1)金属活动相差越大,形成原电池时越容易放电,在串联电路中充当电源,则A池为原电池,B、C为电解池,
故答案为:原电池;电解池;
(2)①为负极,②为正极,负极发生氧化反应,Zn失去电子生成Zn2+,电极反应式为:Zn-2e-═Zn2+,
③连接电源正极,为阳极,发生氧化反应,氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑,
⑤连接电源正极,为阳极,发生氧化反应,银放电生成银离子,电极反应式为:Ag-e-═Ag+,
故答案为:Zn-2e-═Zn2+;2Cl--2e-═Cl2↑;Ag-e-═Ag+;
(3)根据电子转移守恒,反应的Zn的物质的量为$\frac{2mol}{2}$=1mol,参加反应Zn的质量为1mol×65g/mol=65g,即①极上质量减小65g;
⑥为阴极,发生反应:Ag++e-═Ag,根据电子转移守恒,生成析出Ag为$\frac{2mol}{1}$=2mol,析出Ag的质量为2mol×108g/mol=216g,即⑥极上质量增大216g,
故答案为:65;216;
(4)A、B、C三池中C为电镀池,阳极溶解的金属物质的量等于阴极析出金属物质的量且是同一种金属,所以相当于电解质溶液不参加反应,则电解质溶液浓度不变,
故答案为:C.
点评 本题考查原电池、电解池与电镀池,关键是根据题目信息判断A为原电池,串联电路中金属活动相差越大,形成的电势越高,充当电源,其它各池为电解池,理解掌握原电池、电解池与电镀池的构成.

| A. | 氨气可做制冷剂 | |
| B. | 氧化铝可做耐火材料 | |
| C. | 晶体硅可用于制造光导纤维 | |
| D. | 过氧化钠可用于呼吸面具,提供氧气 |
| A. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| B. | 用焰色反应鉴别NaCl固体和NaOH固体 | |
| C. | 用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 | |
| D. | 检验未知溶液是否含SO42ˉ可先加氯化钡,再加稀盐酸 |
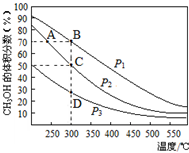 利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )| A. | 该反应的△H<0,且p1<p2 | |
| B. | 反应速率:ν逆(状态A)>ν逆(状态B) | |
| C. | 在C点时,CO转化率为75% | |
| D. | 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同 |
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | C2H4、C3H6和  中均含有碳碳双键 中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
| A. | 向卤代烃水解后的溶液中加入AaNO3溶液,根据沉淀颜色可以判断卤素原子种类 | |
| B. | 银镜反应、乙酸乙酯的水解反应、苯的硝化反应均需水浴加热 | |
| C. | 甲酸酯、葡萄糖、麦芽糖均能发生银镜反应 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是为了得到更多的乙烯、丙烯等气态短链烃 |