题目内容
8.反应 mA+nB?p C在某温度下达到平衡状态.(1)若升高温度,A物质的转化率增大,该反应为吸热反应.
(2)若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向逆(填写“正”或“逆”)反应方向移动.
(3)如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为气(填写“气”、“液”或“固”)态.
(4)若A、B、C均为气体,在密闭容器中,能说明该反应已达到平衡状态的标志是ce
a、容器内总压强不变 b、反应后气体的密度保持不变
c、容器为绝热容器,体系的温度保持不变 d、在单位时间内消耗了m mol A,同时生成了 p mol C
e、各气体的体积分数保持不变 f、反应后气体总的物质的量不变
(5)若A、B、C分别为NO2、O2、N2O5,在25℃、101kPa时,△H=-94.0kJ/mol,△S=-75.8J?mol-1?K-1,设△H和△S不随温度而变,试求此反应自发进行的温度条件为温度小于1240K或小于967℃.
分析 (1)根据影响化学平衡因素结合速率大小分析判断反应前后的体积变化;
(2)反应前后系数相同,改变压强平衡移动说明反应物中含有固体或纯液体;
(3)固体和纯液体对平衡无影响;
(4)可逆反应达到平衡状态,一定满足正逆反应速率相等且不为零,各组分的浓度不再变化;该反应的特点为:一是可逆反应;二是反应前后气体体积不相等;
(5)若A、B、C分别为NO2、O2、N2O5,反应的化学方程式4NO2+O2=2N2O5,在25℃、101kPa时,△H=-94.0kJ/mol,△S=-75.8J?mol-1?K-1,依据△H-T△S<0计算此反应自发进行的温度.
解答 解:(1)反应mA+nB?pC,若升高温度,A物质的转化率增大,平衡正向进行,则正反应为吸热反应,故答案为:吸;
(2)若反应mA+nB?pC;C为气体,且m+n=p,在加压时化学平衡发生移动,说明AB中至少有一种是固体或纯液体,加压平衡逆向进行,故答案为:逆向;
(3)若反应mA+nB?pC;如果在体系中增加或减少B的量,平衡均不发生移动,证明B一定是固体或纯液体,不是气体,故答案为:气;
(4)若A、B、C均为气体,在密闭容器中,
a、反应前后气体体积变化不知,容器内总压强不变,不能说明反应达到平衡状态,故a错误;
b、反应前后气体质量恒容体积不变.反应中气体的密度始终保持不变,不能说明反应达到平衡状态,故b错误;
c、容器为绝热容器,体系的温度保持不变,说明反应达到平衡状态,故C正确;
d、在单位时间内消耗了m mol A,同时生成了 p mol C,只能说明反应正向进行,不能说明反应达到平衡状态,故d错误;
e、各气体的体积分数保持不变是平衡的标志,故e正确;
f、反应前后气体物质的量变化不知,若反应前后气体物质的量不变的反应,反应后气体总的物质的量不变,不能说明反应达到平衡状态,故f错误;
故答案为:ce;
(5)在25℃、101kPa时,△H=-94.0kJ/mol,△S=-75.8J?mol-1?K-1,设△H和△S不随温度而变,则-94.0kJ/mol-T×(-75.8×10-3
KJ.mol-1•K-1)<0,计算得到T<1240K,温度t=1240-273=967℃,
故答案为:温度小于1240K或小于967℃.
点评 本题考查了化学平衡的影响因素判断,反应自发进行的判断依据,平衡标志判断,主要考查压强对平衡的影响和物质性质的判断,化学平衡的移动规律是解题的关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案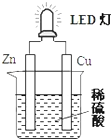
| A. | 铜片表面有气泡生成,锌片上发生氧化反应 | |
| B. | 如果将稀硫酸换成葡萄糖溶液,不能使LED灯发光 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将铜片换成铁片,则锌片为正极 |
| A. | 铅蓄电池放电时的负极和充电时的阳极均发生还原反应 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 | |
| D. | 纯碱溶于热水中去污效果增强,说明纯碱的水解是放热反应 |
| A. | 浓硝酸 | B. | 稀硫酸 | C. | 浓盐酸 | D. | 浓氢氧化钠溶液 |
| A. | Al2O3既不是氧化剂也不是还原剂 | B. | 氧化剂与还原剂物质的量比是1:3 | ||
| C. | AlN是还原产物 | D. | 每生成1 mol AlN有2mol电子转移 |
| A. | 蒸发皿;蒸发后灼烧 | |
| B. | 烧杯;冷却、结晶、过滤 | |
| C. | 分液漏斗;分液 | |
| D. | 分液漏斗;加萃取剂,振荡静置后分液 |
| A. | 碳酸钠溶液 | B. | 钠 | C. | 氧气 | D. | 乙酸 |
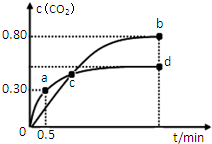 利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H 1
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H 1