题目内容
现有五种可溶性离子化合物 A、B、C、D 和 E,组成它们的离子有:
为鉴别它们,分别完成以下实验,其结果是:
①B 和 E 的水溶液均呈碱性.
②A 溶于水后,与上述某阳离子反应生成的白色沉淀X,X既不溶于氨水也不溶于硝酸,且 A 溶液与过量氨水反应生成白色沉淀Y;
③C 溶液与适量氨水反应生成无色溶液可与葡萄糖溶液发生银镜反应.
④E 溶于水后,与上述某阴离子反应可生成 X;
⑤A溶液与适量 E溶液反应生成白色沉淀,再加入过量 E溶液,沉淀量减少,但不消失.请根据上述实验结果,填空:
(1)写出化合物的化学式:A ,B ,C .
(2)写出D与氨水反应的化学方程式:
(3)写出实验⑤中“再加入过量 E溶液,沉淀量减少”的离子方程式: .
| 阳离子 | K+Ag+ Ba 2+ A13+Fe3+ |
| 阴离子 | OH - C1- SO42-NO3- CO32- |
①B 和 E 的水溶液均呈碱性.
②A 溶于水后,与上述某阳离子反应生成的白色沉淀X,X既不溶于氨水也不溶于硝酸,且 A 溶液与过量氨水反应生成白色沉淀Y;
③C 溶液与适量氨水反应生成无色溶液可与葡萄糖溶液发生银镜反应.
④E 溶于水后,与上述某阴离子反应可生成 X;
⑤A溶液与适量 E溶液反应生成白色沉淀,再加入过量 E溶液,沉淀量减少,但不消失.请根据上述实验结果,填空:
(1)写出化合物的化学式:A
(2)写出D与氨水反应的化学方程式:
(3)写出实验⑤中“再加入过量 E溶液,沉淀量减少”的离子方程式:
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:①B 和 E 的水溶液均呈碱性,说明B、E中含阴离子氢氧根离子或碳酸根离子;
②A 溶于水后,与上述某阳离子反应生成的白色沉淀X,X既不溶于氨水也不溶于硝酸,且 A 溶液与过量氨水反应生成白色沉淀Y;说明A中含硫酸根离子和铝离子,即A为硫酸铝,X为硫酸钡;
③C 溶液与适量氨水反应生成无色溶液可与葡萄糖溶液发生银镜反应,说明C为硝酸银;
④E 溶于水后,与上述某阴离子反应可生成 X,说明E中含钡离子,结合E 的水溶液均呈碱性,说明E为氢氧化钡,所以B为碳酸钾;
⑤A溶液与适量 E溶液反应生成白色沉淀,再加入过量 E溶液,沉淀量减少,但不消失,进一步证明A为硫酸铝,E为氢氧化钡,剩余离子组成D为氯化铁.
根据要求完成填空.
②A 溶于水后,与上述某阳离子反应生成的白色沉淀X,X既不溶于氨水也不溶于硝酸,且 A 溶液与过量氨水反应生成白色沉淀Y;说明A中含硫酸根离子和铝离子,即A为硫酸铝,X为硫酸钡;
③C 溶液与适量氨水反应生成无色溶液可与葡萄糖溶液发生银镜反应,说明C为硝酸银;
④E 溶于水后,与上述某阴离子反应可生成 X,说明E中含钡离子,结合E 的水溶液均呈碱性,说明E为氢氧化钡,所以B为碳酸钾;
⑤A溶液与适量 E溶液反应生成白色沉淀,再加入过量 E溶液,沉淀量减少,但不消失,进一步证明A为硫酸铝,E为氢氧化钡,剩余离子组成D为氯化铁.
根据要求完成填空.
解答:
解:①B 和 E 的水溶液均呈碱性,说明B、E中含阴离子氢氧根离子或碳酸根离子;
②A 溶于水后,与上述某阳离子反应生成的白色沉淀X,X既不溶于氨水也不溶于硝酸,且 A 溶液与过量氨水反应生成白色沉淀Y;说明A中含硫酸根离子和铝离子,即A为硫酸铝,X为硫酸钡;
③C 溶液与适量氨水反应生成无色溶液可与葡萄糖溶液发生银镜反应,说明C为硝酸银;
④E 溶于水后,与上述某阴离子反应可生成 X,说明E中含钡离子,结合E 的水溶液均呈碱性,说明E为氢氧化钡,所以B为碳酸钾;
⑤A溶液与适量 E溶液反应生成白色沉淀,再加入过量 E溶液,沉淀量减少,但不消失,进一步证明A为硫酸铝,E为氢氧化钡,剩余离子组成D为氯化铁.
(1)根据以上推断,A为硫酸铝,B为碳酸钾,C为硝酸银,故答案为:Al2(SO4)3;K2CO3;AgNO3;
(2)D为氯化铁,和氨水反应生成氯化铵和氢氧化铁沉淀,反应方程式为:FeCl3+3NH3.H2O=Fe(OH)3↓+3NH4Cl,故答案为:FeCl3+3NH3.H2O=Fe(OH)3↓+3NH4Cl;
(3)A溶液与适量 E溶液反应生成白色沉淀,为氢氧化铝和硫酸钡沉淀,氢氧化铝能溶于氢氧化钡,故沉淀减少的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
②A 溶于水后,与上述某阳离子反应生成的白色沉淀X,X既不溶于氨水也不溶于硝酸,且 A 溶液与过量氨水反应生成白色沉淀Y;说明A中含硫酸根离子和铝离子,即A为硫酸铝,X为硫酸钡;
③C 溶液与适量氨水反应生成无色溶液可与葡萄糖溶液发生银镜反应,说明C为硝酸银;
④E 溶于水后,与上述某阴离子反应可生成 X,说明E中含钡离子,结合E 的水溶液均呈碱性,说明E为氢氧化钡,所以B为碳酸钾;
⑤A溶液与适量 E溶液反应生成白色沉淀,再加入过量 E溶液,沉淀量减少,但不消失,进一步证明A为硫酸铝,E为氢氧化钡,剩余离子组成D为氯化铁.
(1)根据以上推断,A为硫酸铝,B为碳酸钾,C为硝酸银,故答案为:Al2(SO4)3;K2CO3;AgNO3;
(2)D为氯化铁,和氨水反应生成氯化铵和氢氧化铁沉淀,反应方程式为:FeCl3+3NH3.H2O=Fe(OH)3↓+3NH4Cl,故答案为:FeCl3+3NH3.H2O=Fe(OH)3↓+3NH4Cl;
(3)A溶液与适量 E溶液反应生成白色沉淀,为氢氧化铝和硫酸钡沉淀,氢氧化铝能溶于氢氧化钡,故沉淀减少的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评:本题考查了离子的推断,中等难度,要注意离子的特征反应,根据性质的不同结合现象进行推断.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe2+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生沉淀;过滤、洗涤、灼烧,得到1.6g红棕色固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
| A、至少存在4种离子 |
| B、Cl-一定存在,且c(Cl-)≥0.4mol/L |
| C、SO42-、NH4+、一定存在,Cl-可能不存在 |
| D、CO32-、Al3+一定不存在,K+可能存在 |
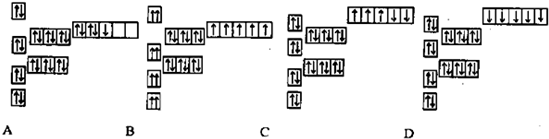
下列有关化学用语错误的是( )
A、Na+的基态电子排布图是: |
B、H2O分子的电子式为: |
| C、Ca2+离子基态电子排布式为:1s22s22p63s23p6 |
D、氯原子结构示意图为: |
常温下,某澄清透明的溶液中可能存在:Fe2+、Cu2+、Mg2+、Al3+、SO32-、Br-、SO42-、NO3-等离子中的一种或几种,现进行了如下实验:

提示:SO32-与Al3+会发生双水解在水溶液中不能大量共存,SO32-与Fe2+、Cu2+、Mg2+会发生反应生成沉淀.
下列说法不正确的是( )

提示:SO32-与Al3+会发生双水解在水溶液中不能大量共存,SO32-与Fe2+、Cu2+、Mg2+会发生反应生成沉淀.
下列说法不正确的是( )
| A、沉淀B中可能含有氢氧化镁肯定含有氢氧化铁 |
| B、溶液中一定不存在SO32- |
| C、溶液中一定存在Fe2+、Al3+、Br-、SO42- |
| D、溶液中一定不存在Fe2+、Cu2+ |
已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
2CO(g)═2C(s)+O2(g)△H=+221kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(l)+2CO(g)△H为( )
2CO(g)═2C(s)+O2(g)△H=+221kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(l)+2CO(g)△H为( )
| A、-162 kJ?mol-1 |
| B、+81 kJ?mol-1 |
| C、+162 kJ?mol-1 |
| D、-81 kJ?mol-1 |

 钙、铝、铜都是中学化学中常见的金属元素.
钙、铝、铜都是中学化学中常见的金属元素.