题目内容
3.下列各组烃中,所取质量一定时,无论以何样的比例混合,燃烧生成的CO2为一定值的是( )| A. | 乙烯和环丙烷 | B. | 甲烷和乙烷 | C. | 丙烯和丙烷 | D. | 丙烷和环丙烷 |
分析 无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成CO2的质量也一定,则说明混合物各组分分子中含碳量相等,若为烃,则烃的最简式一定相等,据此进行计算和判断.
解答 解:各组混合物无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成CO2的质量也一定,则说明混合物各组分分子中碳元素质量分数相等,若均为烃,则H元素质量分数相等,各组分的最简式相同,
A.乙烯和环丙烷的最简式均为CH2,满足条件,故A正确;
B.甲烷和乙烷的最简式不相同,不满足条件,故B错误;
C.丙烯与丙烷的最简式不同,不满足条件,故C错误;
D.丙烷与环丙烷的最简式不相同,不满足条件,故D错误;
故选A.
点评 本题考查混合物反应的有关计算,题目难度中等,注意明确只要总质量一定,完全燃烧时生成CO2的质量也一定,则说明混合物各组分分子中含碳量相等,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
13.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A. | 生成42.0 L N2(标准状况) | |
| B. | 有0.250 mol KNO3被氧化 | |
| C. | 转移电子的物质的量为2.5 mol | |
| D. | 被氧化的N原子的物质的量为3.75 mol |
14.用如图装置进行相关实验,不能达到目的是( )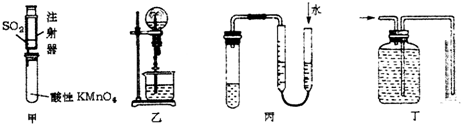

| A. | 可用甲装置来探究SO2的漂白性 | |
| B. | 可用乙装置验证HCl气体极易溶于水 | |
| C. | 用图示的方法可以检查丙装置的气密性 | |
| D. | 可用丁装置测量铜与稀硝酸反应生成气体的体积 |
18.1mol C2H4与Cl2完全加成,再与Cl2彻底取代,两过程共用Cl2( )
| A. | 2 mol | B. | 4mol | C. | 5mol | D. | 6mol |
12.关于合金的下列说法不正确的是( )
| A. | 合金具备金属的特性 | |
| B. | 合金的硬度一般比其组成成分金属的硬度大 | |
| C. | 合金的熔点一般比其组成成分的熔点低 | |
| D. | 合金只能由两种或两种以上的金属组成 |
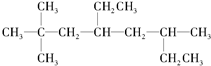 烃A的一氯代物具有不同沸点的产物有10种.
烃A的一氯代物具有不同沸点的产物有10种.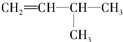 的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.
的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷. 的分子式为C4H8O;
的分子式为C4H8O; 名称为:1,2-二甲基苯(或邻二甲苯).
名称为:1,2-二甲基苯(或邻二甲苯).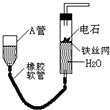 如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题: