题目内容
已知:CH,COOH-CH3COO-+H′AH>O.回答下列问题:
(1)一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图1所示,请回答:

①O点导电能力为O的原因 .
②若使c点溶液中的c(CH3COO-)增大,可以采取的措施是 (填序号,下同).
A.加入CH3COONa固体 B.加入盐酸 C.加入NaOH固体 D.加入水
(2)常温下,下列方法可以使0.10mol?L-1CH3COOH的电离程度增大的是 .
a.加入少量的稀盐酸 b.加热溶液 c.加水稀释至0.010mol?L-1 d.加入少量冰醋酸
(3)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是 .
①因醋酸是弱酸,故反应可进行 ②醋酸铅是弱电解质
③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
(4)某温度下醋酸的电离常数K=1.6×10-5mol?L-1.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.lmol/L KOH溶液,其pH变化曲线如图2所示(忽略温度变化),则a、b、c三点中水的电离程度虽大的是 .
(5)等物质的量浓度的醋酸和氢氧化钠等体积混合后.所得溶液中各种离子浓度从大到小的顺序为 .
(6)在25℃下,将6mol?L-1的醋酸溶液与0.01mol?L-1的氢氧化钠溶液等体积混合,
反应后,溶液中c(CH3COO-)=c(Na+),则溶液显 性(填“酸”、“碱”或“中”);用含6的代数式表示醋酸的电离常数Kα= .
(1)一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图1所示,请回答:

①O点导电能力为O的原因
②若使c点溶液中的c(CH3COO-)增大,可以采取的措施是
A.加入CH3COONa固体 B.加入盐酸 C.加入NaOH固体 D.加入水
(2)常温下,下列方法可以使0.10mol?L-1CH3COOH的电离程度增大的是
a.加入少量的稀盐酸 b.加热溶液 c.加水稀释至0.010mol?L-1 d.加入少量冰醋酸
(3)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是
①因醋酸是弱酸,故反应可进行 ②醋酸铅是弱电解质
③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
(4)某温度下醋酸的电离常数K=1.6×10-5mol?L-1.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.lmol/L KOH溶液,其pH变化曲线如图2所示(忽略温度变化),则a、b、c三点中水的电离程度虽大的是
(5)等物质的量浓度的醋酸和氢氧化钠等体积混合后.所得溶液中各种离子浓度从大到小的顺序为
(6)在25℃下,将6mol?L-1的醋酸溶液与0.01mol?L-1的氢氧化钠溶液等体积混合,
反应后,溶液中c(CH3COO-)=c(Na+),则溶液显
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)①纯醋酸中只含有分子,没有离子;
②要使醋酸根离子浓度增大,可以采用加热、加入含有醋酸根离子的物质、加入和氢离子反应的物质;
(2)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(3)硫酸铅在水溶液里存在溶解平衡,加入醋酸时,醋酸根离子和铅离子生成弱电解质醋酸铅,促进硫酸铅溶解;
(4)酸和碱抑制水的电离,能水解的盐促进水电离;
(5)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,恰好生成CH3COONa,醋酸根离子水解显碱性;
(6)根据电荷守恒分析;呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.005mol/L,以此计算.
②要使醋酸根离子浓度增大,可以采用加热、加入含有醋酸根离子的物质、加入和氢离子反应的物质;
(2)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(3)硫酸铅在水溶液里存在溶解平衡,加入醋酸时,醋酸根离子和铅离子生成弱电解质醋酸铅,促进硫酸铅溶解;
(4)酸和碱抑制水的电离,能水解的盐促进水电离;
(5)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,恰好生成CH3COONa,醋酸根离子水解显碱性;
(6)根据电荷守恒分析;呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.005mol/L,以此计算.
解答:
解:(1)①纯醋酸中只含有分子,没有离子,所以不导电,故答案为:O点为纯的醋酸,没有离子;
②要使醋酸根离子浓度增大,可以采用加热、加入含有醋酸根离子的物质、加入和氢离子反应的物质,
A.加固体CH3COONa,能抑制醋酸电离,但醋酸钠电离出的醋酸根离子大于抑制醋酸电离出的醋酸根离子,所以醋酸根离子浓度增大,故正确;
B.加入盐酸,氢离子浓度增大,抑制醋酸电离,导致醋酸根离子浓度减小,故错误;
C.加NaOH固体,氢氧化钠和氢离子反应促进醋酸电离,所以醋酸根离子浓度增大,故正确;
D.加水稀释能促进醋酸电离,但醋酸根离子浓度减小,故错误;
故答案为:AC;
(2)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入少量的盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加水稀释至0.010mol?L-1,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
故答案为:bc;
(3)硫酸铅在水溶液里存在溶解平衡,加入醋酸时,醋酸根离子和铅离子生成弱电解质醋酸铅,促进硫酸铅溶解,
故答案为:②;
(4)a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点可看做是CH3COOK和极少量CH3COOH的混合溶液,酸能抑制水的电离,酸的浓度越大,抑制能力越强,所以c点溶液中水的电离程度最大,
故答案为:c;
(5)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,恰好生成CH3COONa,醋酸根离子水解显碱性;则溶液中的离子浓度从大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(6)由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),已知溶液中c(CH3COO-)═c(Na+),则c(H+)=c(OH-),即溶液显中性;呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.005mol/L,所以用含6的代数式表示CH3COOH的电离常数Ka=
=
mol?L-1,
故答案为:
mol?L-1.
②要使醋酸根离子浓度增大,可以采用加热、加入含有醋酸根离子的物质、加入和氢离子反应的物质,
A.加固体CH3COONa,能抑制醋酸电离,但醋酸钠电离出的醋酸根离子大于抑制醋酸电离出的醋酸根离子,所以醋酸根离子浓度增大,故正确;
B.加入盐酸,氢离子浓度增大,抑制醋酸电离,导致醋酸根离子浓度减小,故错误;
C.加NaOH固体,氢氧化钠和氢离子反应促进醋酸电离,所以醋酸根离子浓度增大,故正确;
D.加水稀释能促进醋酸电离,但醋酸根离子浓度减小,故错误;
故答案为:AC;
(2)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入少量的盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加水稀释至0.010mol?L-1,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
故答案为:bc;
(3)硫酸铅在水溶液里存在溶解平衡,加入醋酸时,醋酸根离子和铅离子生成弱电解质醋酸铅,促进硫酸铅溶解,
故答案为:②;
(4)a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点可看做是CH3COOK和极少量CH3COOH的混合溶液,酸能抑制水的电离,酸的浓度越大,抑制能力越强,所以c点溶液中水的电离程度最大,
故答案为:c;
(5)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,恰好生成CH3COONa,醋酸根离子水解显碱性;则溶液中的离子浓度从大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(6)由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),已知溶液中c(CH3COO-)═c(Na+),则c(H+)=c(OH-),即溶液显中性;呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.005mol/L,所以用含6的代数式表示CH3COOH的电离常数Ka=
| 10-7×0.005 | ||
|
| 10-9 |
| 6-0.01 |
故答案为:
| 10-9 |
| 6-0.01 |
点评:本题考查了弱电解质的电离、酸碱混合的计算和定性分析,侧重学生分析能力及计算能力的考查,涉及盐类水解、酸碱混合、pH与浓度的关系等,注意电荷守恒和物料守恒的应用,题目难度中等.

练习册系列答案
相关题目
化学与技术、社会和环境密切相关.下列说错误的是( )
| A、煤炭经气化、液化和干馏等过程,可以转化为清洁能源 |
| B、利用二氧化碳制造全降解塑料,可以缓解温室效应 |
| C、充分开发利用天然纤维,停止使用各种化学合成材料 |
| D、加大秸秆的综合利用,如发酵制沼气、生产乙醇等,提高资源的利用率 |
下列离子在指定溶液中一定能大量共存的是( )
| A、碱性溶液中:Na+、K+、SO32-、S2- |
| B、无色溶液中:Na+、Fe3+、Cl-、SO42- |
| C、无色溶液中:Na+、K+、HCO3-、AlO2- |
| D、酸性溶液中:Na+、K+、NO3-、ClO- |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A、实验室制备氢气 |
| B、Ba(OH)2?8H2O与NH4Cl的反应 |
| C、灼热的碳与水的反应 |
| D、铝粉与氧化铁粉末反应 |


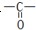 和C-OH两种原子团,A可能的结构简式为(写出一种即可)
和C-OH两种原子团,A可能的结构简式为(写出一种即可)