题目内容
3.在20L氧气中充分燃烧4.0L乙烷,反应后的体积为多少?如将生成的气体通入足量石灰水中,剩余气体的体积是多少?(气体体积均为常温时的体积)分析 乙烷充分燃烧:C2H6+$\frac{7}{2}$O2$\stackrel{点燃}{→}$2CO2+3H2O,根据方程式计算消耗氧气体积、生成二氧化碳的体积,反应后体积为二氧化碳与剩余氧气体积之和,再通入足量的石灰水,最终剩余气体为氧气.
解答 解:由C2H6+$\frac{7}{2}$O2$\stackrel{点燃}{→}$2CO2+3H2O,可知4L乙烷完全反应,消耗氧气体积为4L×$\frac{7}{2}$=14L、生成二氧化碳的体积为4L×2=8L,剩余氧气体积为20L-14L=6L,反应后的体积为8L+6L=14L,再通入足量的石灰水,最终剩余气体为氧气,即剩余气体体积为6L,
答:反应后的体积为14L,将生成的气体通入足量石灰水中,剩余气体的体积是6L.
点评 本题考查化学方程式计算,题目贴近教材,基础性强,旨在考查学生对基础知识的掌握.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
13.关于0.1mol•L-1 NaHCO3溶液,下列说法正确的是( )
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 微粒浓度关系:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
11.下列离子方程式正确的是( )
| A. | 金属钠与水反应:Na+H2O═Na++H2 | |
| B. | 氯化铵溶液显酸性的原因:NH4++H2O═NH3•H2O+H+ | |
| C. | AICl3溶液中加入足量氨水:Al3++4NH3•H2O═AlO2-+4NH4+2H2O | |
| D. | 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S═2Fe2++S+2H+ |
18.下列物质一定属于同系物的是( )
① ②
② ③
③
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6
⑦ ⑧
⑧
①
 ②
② ③
③
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6
⑦
 ⑧
⑧
| A. | ①和② | B. | ④和⑥ | C. | ⑤和⑥ | D. | ④和⑧ |
8.红没药醇是春黄菊花中的活性成分,具有消炎的作用,其结构如图所示.下列有关红没药醇的说法错误的是( )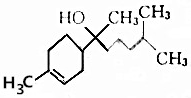

| A. | 分子式为C15H26O | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能与乙酸发生取代反应 |
6.一个恒容容器中盛有1molNO2,发生反应:2NO2(g)?N2O4(g),反应达到平衡时,混合气体中NO2所占体积分数为M%.保持温度不变,再投入1molNO2,达到平衡时,混合气体中NO2所占体积分数为N%.则M和N的关系是( )
| A. | M>N | B. | M<N | C. | M=N | D. | 不能确定 |
3.某种催化剂为铁的氧化物.化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后出现红色.一位同学由此得出该催化剂中铁元素价态为+3的结论.
(1)请指出该结论是否合理并说明理由不合理,Fe2+会被硝酸氧化为Fe3+,无法得知原催化剂中一定是否存在Fe3+.
(2)请完成对铁元素价态的探究:限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;3mol•L-1H2SO4、3% H2O2、6mol•L-1HNO3、0.01mol•L-1KMnO4、NaOH稀溶液、0.1mol•L-1Kl、
20% KSCN、蒸馏水.
①提出合理假设
假设1:该催化剂中铁元素价态为+3;
假设2:该催化剂中铁元素价态为+2;
假设3:该催化剂中铁元素价态既有+2,也有+3.
②以下是某同学设计的实验验证方案,请将实验操作步骤、预期现象与结论补充完整.
(1)请指出该结论是否合理并说明理由不合理,Fe2+会被硝酸氧化为Fe3+,无法得知原催化剂中一定是否存在Fe3+.
(2)请完成对铁元素价态的探究:限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;3mol•L-1H2SO4、3% H2O2、6mol•L-1HNO3、0.01mol•L-1KMnO4、NaOH稀溶液、0.1mol•L-1Kl、
20% KSCN、蒸馏水.
①提出合理假设
假设1:该催化剂中铁元素价态为+3;
假设2:该催化剂中铁元素价态为+2;
假设3:该催化剂中铁元素价态既有+2,也有+3.
②以下是某同学设计的实验验证方案,请将实验操作步骤、预期现象与结论补充完整.
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解; | 溶液呈黄绿色,说明溶液中可能含Fe2+和Fe3+. |
| 步骤2:取少量溶液,滴 加0.01mol/L的KMnO4溶液. | 若紫红色不褪去,则说明催化剂中含铁元素的价态+3价;若紫红色褪去, 则说明催化剂中含有铁元素的价态为+2价 |
| 步骤3:另取少量溶液,滴 加20%的KSCN溶液. | 若溶液变为血红色,则说明催化剂中含铁元素的价态+3价;若溶液无变化,则说明催化剂中含铁元素的价态+2价; |
4.在空气中久置而不易变质的物质是( )
| A. | 过氧化钠 | B. | 纯碱 | C. | 漂粉精 | D. | 氯水 |