题目内容
18.常温下,在溶液中能发生如下反应:①2A2++B2=2A3++2B-;②16H++10Z-+2XO4-?2X2++5Z2+8H2O③2B-+Z2=B2+2Z-,由此判断下列说法错误的是( )| A. | Z2+2A2+=2A3++2Z-反应可以进行 | |
| B. | Z元素在②③反应中均被还原 | |
| C. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ | |
| D. | 还原性由强到弱顺序是A2+、B-、Z-、X2+ |
分析 A、化合价降低的元素在反应中被还原;
B、氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性;
C、氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性;
D、氧化还原反应中,还原剂的还原性强于还原产物的还原性.
解答 解:A、根据反应2A2++B2=2A3++2B-,可得氧化性是B2>A3+,2B-+Z2=B2+2Z-,可得氧化性是Z2>B2>A3+,反应Z2+2A2+=2A3++2Z-可以进行,故A正确;
B、Z元素在②中化合价升高,在反应中被氧化,在③中化合价降低,在反应中被还原,故B错误;
C、氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,反应②16H++10Z-+2XO4-=2X2++5Z2+8H2O中,氧化性XO4->Z2;反应①2A2++B2=2A3-+2B-中,氧化性B2>A3+;反应③2B-+Z2=B2+2Z-中,氧化性Z2>B2,所以氧化性由强到弱的顺序是XO4->Z2>B2>A3+,故C正确;
D、氧化还原反应中,还原剂的还原性强于还原产物的还原性,反应②16H++10Z-+2XO4-=2X2++5Z2+8H2O中,还原性Z->X2+;反应①2A2++B2=2A3-+2B-中,还原性A2+>B-;反应③2B-+Z2=B2+2Z-中,还原性B->Z-,所以还原性由强到弱的顺序是A2+>B->Z->X2+,故D正确.
故选B.
点评 本题考查学生氧化还原反应中氧化性和还原性强弱判断规律:氧化还原反应中还原剂的还原性强于还原产物的还原性,氧化剂的氧化性强于氧化产物的氧化性.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
8.下列说法正确的是( )
| A. | 因为非金属性Cl强于S,所以向Na2SO3溶液中加盐酸,有气泡产生 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| D. | SiO2既能和氢氧化钠溶液反应也能和氨氟酸反应,所以是两性氧化物 |
9.分类是化学研究中常用的方法,下列分类说法中正确的是( )
| A. | 电离产生阳离子全部是H+化合物叫酸,根据其分子中氢原子的个数确定该酸的元数 | |
| B. | 依据组成元素的种类,将纯净物分为单质和化合物 | |
| C. | 根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物和酸性氧化物 | |
| D. | 根据分散质微粒直径大小,将分散系分为胶体、浊液和溶液 |
13.3g镁铝合金与100mL稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4g,则原硫酸的物质的量浓度为( )
| A. | 1mol•L-1 | B. | 1.5mol•L-1 | C. | 2mol•L-1 | D. | 2.5mol•L-1 |
3.下列说法正确的是( )
| A. | 含碳元素的化合物都是有机物 | |
| B. | 完全燃烧只生成 CO2和 H2O 的化合物都是烃 | |
| C. | 有机物完全燃烧只可能生成 CO2 和 H2O | |
| D. | 点燃混有空气的甲烷不一定会爆炸 |
10.某公司设计的用于驱动潜艇的液氨-液氧燃料电池示意图如下,有关说法正确的是( )
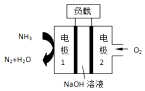

| A. | 电池总反应为:4NH3+3O2=2N2+6H2O | |
| B. | 电池工作时,OH-向正极移动 | |
| C. | 电极 2 发生的电极反应为:O2+4H++4e-=2H2O | |
| D. | 电流由电极 1 经外电路流向电极2 |
7.下列各物质在反应中做为反应物时仅能体现还原性的是( )
| A. | 金属钠 | B. | 稀盐酸 | C. | 硫酸铜 | D. | 氯酸钾 |