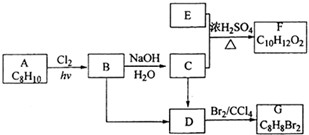
题目内容
下列溶液中Cl-的物质的量浓度与l00mL1moL/LMgCl2溶液中Cl-的物质的量浓度相同的是( )
| A、50mL2mol/LCaCl2溶液 |
| B、100mL2moL/LNaCl溶液 |
| C、50mL4mol/LCaCl2溶液 |
| D、100mL4mol/LNaCl溶液 |
考点:物质的量浓度的相关计算
专题:
分析:1mol/LMgCl2溶液中Cl-的物质的量浓度为2mol/L,计算选项中氯离子的浓度,注意离子浓度与溶液体积无关,与电解质电离的离子数目有关,对于不发生水解的离子浓度=电解质浓度×电离出相应离子数目,据此进行判断.
解答:
解:100mL 1mol?L-1 MgCl2溶液中Cl-的物质的量浓度为:c(Cl-)=2c(MgCl2)=2mol/L,
A、50mL0.5mol?L-1CaCl2溶液中Cl-的物质的量浓度为:c(Cl-)=2c(CaCl2)=1mol/L,故A错误;
B、100mL2mol?L-1NaCl溶液中Cl-的物质的量浓度为:c(Cl-)=c(NaCl)=2mol/L,故B正确;
C、50mL4mol?L-1CaCl2溶液中Cl-的物质的量浓度为:c(Cl-)=2c(CaCl2)=8mol/L,故C错误;
D、100mL4mol?L-1NaCl溶液中Cl-的物质的量浓度为:c(Cl-)=c(NaCl)=4mol/L,故D错误;
故选B.
A、50mL0.5mol?L-1CaCl2溶液中Cl-的物质的量浓度为:c(Cl-)=2c(CaCl2)=1mol/L,故A错误;
B、100mL2mol?L-1NaCl溶液中Cl-的物质的量浓度为:c(Cl-)=c(NaCl)=2mol/L,故B正确;
C、50mL4mol?L-1CaCl2溶液中Cl-的物质的量浓度为:c(Cl-)=2c(CaCl2)=8mol/L,故C错误;
D、100mL4mol?L-1NaCl溶液中Cl-的物质的量浓度为:c(Cl-)=c(NaCl)=4mol/L,故D错误;
故选B.
点评:本题考查离子浓度的计算,题目难度不大,试题侧重基础知识的考查,注意离子浓度与溶质浓度的关系即可解答,注意离子浓度与溶液的体积大小无关.

练习册系列答案
相关题目
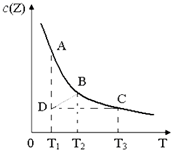 已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )
已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )| A、B点对应的反应速率大于C点对应的反应速率 |
| B、状态A的c(Y)大于状态D c(Y) |
| C、反应X(g)+3Y(g)?2Z(g)的△H<0 |
| D、其他条件不变,缩小容器的体积,平衡可由D点移动到B点 |
下列各种镀有金属保护层的铁板,当镀层破损时相同的普通环境中,最易被腐蚀的是( )
| A、镀锌铁(白铁) |
| B、镀锡铁(马口铁) |
| C、镀银铁 |
| D、镀铜铁 |
铅蓄电池在现代生活中有广泛的应用.其电极材料是Pb和PbO2,电解质是稀硫酸.Pb+PbO2+2H2SO4
2PbSO4+2H2O,下列说法正确的是( )
| 放电 |
| 充电 |
| A、铅蓄电池使用一段时间后要添加硫酸 |
| B、电池充电时,阴极反应为:Pb-2e-+SO42-═PbSO4 |
| C、电池充电时,电池正极应和电源的正极相连接 |
| D、电池放电时,电池正极周围溶液pH不断增大 |
已知下列热化学方程式:( )
(1)CH3COOH(1)+2O2(g)═2CO2(g)+2HO(1)△H1=-870.3kJ.mol-1
(2)C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
(3)H2(g)+
O2(g)═H2O(1)△H3=-285.8kJ.mol-1
则反应:2C(g)+2H2(g)+O2(g)═CH3COOH(1)的反应热为.
(1)CH3COOH(1)+2O2(g)═2CO2(g)+2HO(1)△H1=-870.3kJ.mol-1
(2)C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
(3)H2(g)+
| 1 |
| 2 |
则反应:2C(g)+2H2(g)+O2(g)═CH3COOH(1)的反应热为.
| A、-488.3kJ.mol-1 |
| B、-244.15kJ.mol-1 |
| C、+488.3kJ.mol-1 |
| D、+244.15-488.3kJ.mol-1 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1molN2所含有的原子数为NA |
| B、标准状况下,22.4L水中含有的水分子数为NA |
| C、标准状况下,22.4L氯化氢所含的原子数为NA |
| D、24gO2分子和24gO3分子所含的氧原子数目相等 |
设为阿伏加德罗常数的值,下列说法不正确的是( )
| A、标准状况下,22.4L水中含有的氧原子数为NA |
| B、0.3molNO2与水反应时转移的电子数为0.2NA |
| C、标准状况下,28gN2和CO所组成的混合气体,其体积为22.4L |
| D、足量铁粉与1molCl2在加热条件下充分反应,转移的电子数为2NA |
 导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.