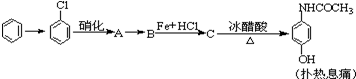
题目内容
设为阿伏加德罗常数的值,下列说法不正确的是( )
| A、标准状况下,22.4L水中含有的氧原子数为NA |
| B、0.3molNO2与水反应时转移的电子数为0.2NA |
| C、标准状况下,28gN2和CO所组成的混合气体,其体积为22.4L |
| D、足量铁粉与1molCl2在加热条件下充分反应,转移的电子数为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标况下,水为液态;
B、二氧化氮与水的反应,二氧化氮既是氧化剂,又是还原剂;
C、N2和CO的摩尔质量均为28g/mol;
D、根据反应后氯元素为-1价来分析.
B、二氧化氮与水的反应,二氧化氮既是氧化剂,又是还原剂;
C、N2和CO的摩尔质量均为28g/mol;
D、根据反应后氯元素为-1价来分析.
解答:
解:A、标况下,水为液态,故A错误;
B、0.3molNO2,与水反应,二氧化氮既是氧化剂,又是还原剂,被还原的有
×0.3mol,由+4价被还原为+2价,故转移电子物质的量是 0.2mol,故B正确;
C、N2和CO的摩尔质量均为28g/mol,故28g混合气体的物质的量为1mol,标况下体积为22.4L,故C正确;
D、反应后氯元素的价态为-1价,故1mol氯气参与反应转移2mol电子,故D正确.
故选A.
B、0.3molNO2,与水反应,二氧化氮既是氧化剂,又是还原剂,被还原的有
| 1 |
| 3 |
C、N2和CO的摩尔质量均为28g/mol,故28g混合气体的物质的量为1mol,标况下体积为22.4L,故C正确;
D、反应后氯元素的价态为-1价,故1mol氯气参与反应转移2mol电子,故D正确.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
相关题目
下列溶液中Cl-的物质的量浓度与l00mL1moL/LMgCl2溶液中Cl-的物质的量浓度相同的是( )
| A、50mL2mol/LCaCl2溶液 |
| B、100mL2moL/LNaCl溶液 |
| C、50mL4mol/LCaCl2溶液 |
| D、100mL4mol/LNaCl溶液 |
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、22.4 L氢气中,一定含有氢原子2NA |
| B、在常温常压下,28gCO和N2的混合气体中含有的分子数为NA |
| C、常温下,pH=1的盐酸溶液,含有H+数目是0.1NA |
| D、标准状态下,2.7g铝和足量的浓硝酸反应,转移的电子数是0.3NA |
下列离子方程式中,正确的是( )
| A、过氧化钠与水反应2O22-+2H2O=4OH-+O2↑ |
| B、铝与氢氧化钠溶液反应Al+OH-+H2O=AlO2-+H2↑ |
| C、硫酸铝和氨水反应Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、氯气与氢氧化钠溶液反应Cl2+2OH-=Cl-+ClO-+H2O |
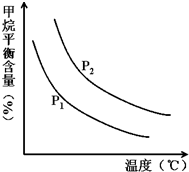 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下: