题目内容
1.常温下,用0.1mol•L-1NaOH溶液滴定0.1mol•L-1HA溶液,滴定曲线如下,下列分析错误的是( )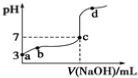
| A. | 由a点推知HA是弱酸 | B. | a、b点的溶液中,水的电离程度:a<b | ||
| C. | c点的溶液中:c(Na+)=c(A-)+c(HA) | D. | d点的溶液中:c(Na+)>c(A-) |
分析 A.a点时没有滴入氢氧化钠溶液,此时溶液的pH=3,而HA的标点为0.1mol/L,据此可判断HA为弱酸;
B.a、b两点都抑制了水的电离,氢离子浓度越大,水的电离程度越小;
C.c点溶液的pH=7,为中性,结合电荷守恒判断;
D.d点溶液呈碱性,则c(H+)>c(OH-),结合电荷守恒判断c(Na+)、c(A-)大小.
解答 解:A.a点为0.1mol/L的HA溶液,其pH=3,说明HA在溶液中部分电离出氢离子,则HA为弱酸,故A正确;
B.a、b点的溶液都呈酸性,氢离子抑制了水的电离,由于a点氢离子浓度大于b,则水的电离程度:a<b,故B正确;
C.c点的溶液呈中性,则:c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(A-),故C错误;
D.根据图示可知,d点显示碱性:c(H+)<c(OH-),结合电荷守恒可知:c(Na+)>c(A-),故D正确;
故选C.
点评 本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,正确判断HA为弱电解质为解答关键,注意掌握电荷守恒在判断离子浓度大小中的应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
11.下列有关化学用语使用正确的是( )
| A. | CO2的球棍模型: | B. | 乙烷的结构式:CH3CH3 | ||
| C. | S2-的结构示意图: | D. | Na2S的电子式: |
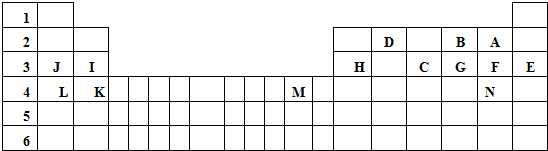
9.下列关于元素周期表的说法中,正确的是( )
| A. | 元素族序数一定等于它的最外层电子数 | |
| B. | 同周期元素的电子层数都相同 | |
| C. | 最外层电子数相同的元素都在同一族 | |
| D. | 周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
16.区别二氧化硫气体和二氧化碳气体的方法最佳是( )
| A. | 通入澄清的石灰水 | B. | 根据有无毒性 | ||
| C. | 用湿润的蓝色石蕊试纸 | D. | 用品红溶液 |
13.常温下,在100ml 12mol•L-1的浓HNO3中加入足量的铁粉,最终产生标准状况下气体的体积可能为(不考虑NO2转化为N2O4)( )
| A. | 6.72 L | B. | 8.98 L | C. | 11.56 L | D. | 13.44 L |
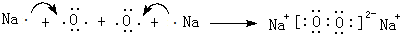 .
.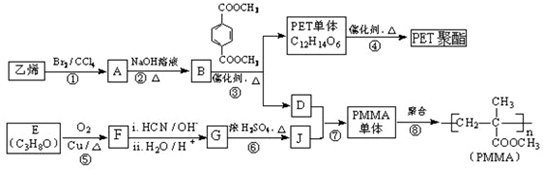
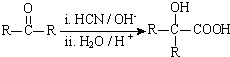 (R、R′代表烃基)
(R、R′代表烃基)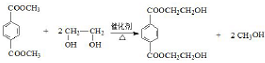 ;
; ;
;