题目内容
已知:Ⅰ.断裂1mol N-N键吸收167kJ热量,形成1mol N≡N键放出942kJ热量,Ⅱ.N2 (g)+3H2(g)2NH3(g);△H1=-92.2kJ?mol-1对于反应:N4 (g)+6H2 (g)4NH3(g);△H2(kJ?mol-1),以下说法正确的是( )
| A、该反应的反应热△H2>0 |
| B、N2分子比 N4分子更稳定 |
| C、△H2=2△H1 |
| D、△H2与方程式系数无关 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:1molN4 分子中含有6molN-N,N≡N的键能为942kJ/mol,N-N键的键能为167kJ/mol,生成1molN4的反应为:2N2(g)=N4(g),反应热△H=2×942kJ/mol-6×167kJ/mol=+882kJ/mol,可见2molN2(g)比1molN4(g)能量低,据此分析.
解答:
解:1molN4 分子中含有6molN-N,N≡N的键能为942kJ/mol,N-N键的键能为167kJ/mol,生成1molN4的反应为:2N2(g)=N4(g),反应热△H=2×942kJ/mol-6×167kJ/mol=+882kJ/mol,可见2molN2(g)比1molN4(g)能量低882KJ,
A、2molN2(g)比1molN4(g)能量还要低,所以△H2<0,故A错误;
B、能量越低越稳定,2molN2(g)比1molN4(g)能量低,故B正确;
C、2molN2(g)不等于1molN4(g)能量,所以故C错误;
D、焓变的数值大小决定于反应的化学计量数,故D错误.
故选:B.
A、2molN2(g)比1molN4(g)能量还要低,所以△H2<0,故A错误;
B、能量越低越稳定,2molN2(g)比1molN4(g)能量低,故B正确;
C、2molN2(g)不等于1molN4(g)能量,所以故C错误;
D、焓变的数值大小决定于反应的化学计量数,故D错误.
故选:B.
点评:本题通过键能,考查焓变的求算以及焓变的大小,本题关键是明确N4的结构类似与白磷.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量 |
| B、任何放热反应在常温条件下一定能发生反应 |
| C、形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为吸热反应 |
| D、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
下列过程或事实不涉及氧化还原反应的是( )
①蔗糖炭化 ②用氢氟酸雕刻玻璃 ③铁遇冷的浓硫酸钝化 ④装碱液的试剂瓶不用玻璃塞 ⑤雷雨发庄稼 ⑥实际使用的浓硝酸显黄色.
①蔗糖炭化 ②用氢氟酸雕刻玻璃 ③铁遇冷的浓硫酸钝化 ④装碱液的试剂瓶不用玻璃塞 ⑤雷雨发庄稼 ⑥实际使用的浓硝酸显黄色.
| A、①③⑤⑥ | B、②④ |
| C、②③④⑥ | D、①②③④⑤⑥ |
一定量的硫酸与足量的锌粒发生反应,为减缓反应速率,且不影响生成氢气的总量,采取的措施有①改用等量锌粉、②加一定量的水、③加入适量KNO3溶液、④加CH3COONa固体、⑤加入NaOH溶液、⑥加热.其中正确的有( )
| A、②④ | B、②③④ |
| C、①⑥ | D、②③④⑤ |
下列叙述正确的是( )
| A、1 mol CO2 的质量为44g/mol |
| B、NA个CO2的质量与CO2的相对分子质量在数值上相同 |
| C、CO2的摩尔质量为44g/mol |
| D、CO2的摩尔质量等于CO2的相对分子质量 |
 利用如装置能制取并收集到相应气体的是( )
利用如装置能制取并收集到相应气体的是( )| A、浓氨水与固体CaO制氨气 |
| B、浓盐酸与KClO3固体制氯气 |
| C、稀硝酸与铜片制NO |
| D、饱和食盐水与电石制乙炔 |
已知将液溴滴入热的NaOH浓溶液中,发生如下氧化还原反应:3Br2+6NaOH=5NaBr+NaBrO3+3H2O,氧化剂和还原剂的物质的量之比正确的是( )
| A、.1:2 | B、.1:5 |
| C、.5:1 | D、2:1 |
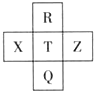 五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )
五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )| A、Z为Cl |
| B、非金属性:X<T |
| C、原子半径:R<T<Q |
| D、最高价氧化物的水化物的酸性:T>Q |
 (1)电镀时,镀件与电源的
(1)电镀时,镀件与电源的