题目内容
过氧化钠保存不当容易变质,生成Na2CO3.
(1)某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液,证明过氧化钠已经变质
(2)检验样品中还有过氧化钠的方法是
(3)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数.
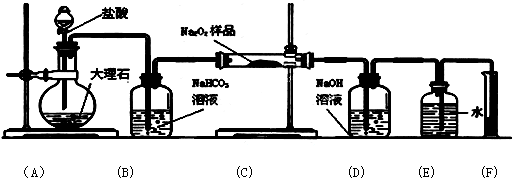
上图中的E和F构成量气装置,用来测定O2的体积.
①写出装置A和B中发生反应的离子方程式:
装置A: 、装置B:
②NaOH的作用是
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为 .
(1)某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液,证明过氧化钠已经变质
(2)检验样品中还有过氧化钠的方法是
(3)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数.

上图中的E和F构成量气装置,用来测定O2的体积.
①写出装置A和B中发生反应的离子方程式:
装置A:
②NaOH的作用是
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
考点:钠的重要化合物
专题:几种重要的金属及其化合物
分析:(1)根据过氧化钠样品已经变质生成Na2CO3,碳酸根离子和Ca2+或Ba2+生成碳酸钙或碳酸钡沉淀;
(2)根据过氧化钠和空气中水反应生成氢氧化钠和氧气,过氧化钠和二氧化碳反应生成碳酸钠和氧气;
(3)A装置盐酸和大理石反应制取二氧化碳,B装置用来除去挥发的氯化氢,C装置中过氧化钠和二氧化碳反应,D装置用来吸收未反应的二氧化碳,E、F用来量取生成气体的体积.依据量筒读取液体体积时需要先冷却至室温及和集气瓶液面相平确定操作顺序;依据生成氧气的体积计算物质的量,结合化学方程式计算得到过氧化钠物质的量,得到过氧化钠的质量分数.
(2)根据过氧化钠和空气中水反应生成氢氧化钠和氧气,过氧化钠和二氧化碳反应生成碳酸钠和氧气;
(3)A装置盐酸和大理石反应制取二氧化碳,B装置用来除去挥发的氯化氢,C装置中过氧化钠和二氧化碳反应,D装置用来吸收未反应的二氧化碳,E、F用来量取生成气体的体积.依据量筒读取液体体积时需要先冷却至室温及和集气瓶液面相平确定操作顺序;依据生成氧气的体积计算物质的量,结合化学方程式计算得到过氧化钠物质的量,得到过氧化钠的质量分数.
解答:
解:(1)碳酸根离子和Ca2+或Ba2+生成碳酸钙或碳酸钡沉淀,滴加氯化钡或氯化钙生成白色沉淀,证明含碳酸根离子,说明过氧化钠样品已经变质,故答案为:取少量样品,溶解,加入BaCl2溶液,充分振荡,有白色沉淀,证明Na2O2已经变质;
(2)过氧化钠和空气中水反应生成氢氧化钠和氧气,把带有火星的木条伸入试管中,木条复燃,证明样品中仍有Na2O2,故答案为:取少量样品放入试管中,再加入适量的水,把带有火星的木条伸入试管中,木条复燃,证明样品中仍有Na2O2;
(3)①A中盐酸和大理石反应生成氯化钙、二氧化碳和水,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;B中二氧化碳中氯化氢和碳酸氢钠反应生成氯化钠、二氧化碳和水,反应的离子方程式为:HCO3-+H+=CO2↑+H2O,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;HCO3-+H+=CO2↑+H2O;
②氢氧化钠和二氧化碳反应,吸收二氧化碳,便于测量氧气的体积,故答案为:吸收混合气体中二氧化碳,便于测量氧气的体积;
③测定出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,物质的量=
,则样品中过氧化钠的质量分数为=
×100%=
%,故答案为:
%.
(2)过氧化钠和空气中水反应生成氢氧化钠和氧气,把带有火星的木条伸入试管中,木条复燃,证明样品中仍有Na2O2,故答案为:取少量样品放入试管中,再加入适量的水,把带有火星的木条伸入试管中,木条复燃,证明样品中仍有Na2O2;
(3)①A中盐酸和大理石反应生成氯化钙、二氧化碳和水,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;B中二氧化碳中氯化氢和碳酸氢钠反应生成氯化钠、二氧化碳和水,反应的离子方程式为:HCO3-+H+=CO2↑+H2O,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;HCO3-+H+=CO2↑+H2O;
②氢氧化钠和二氧化碳反应,吸收二氧化碳,便于测量氧气的体积,故答案为:吸收混合气体中二氧化碳,便于测量氧气的体积;
③测定出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,物质的量=
| V×10 -3L |
| 22.4L/mol |
| ||
| ag |
| 39V |
| 56a |
| 39V |
| 56a |
点评:本题考查了物质组成的实验探究方法,实验设计方法,实验计算应用,装置图的分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
下列有关说法不正确的是( )
| A、SO42-的空间构型是正四面体形 |
| B、CS2分子中各原子均达8电子稳定结构 |
| C、CH3COOH分子中碳原子的杂化类型有sp2和sp3两种 |
| D、H2O2分子是既含极性键又含非极性键的非极性分子 |
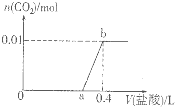 向NaOH和Na2CO3混合溶液中滴加0.1molgL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )
向NaOH和Na2CO3混合溶液中滴加0.1molgL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )| A、在0-a范围内,只发生中和反应 |
| B、ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O |
| C、a=0.2 |
| D、原混合溶液中NaOH与Na2CO3的物质的量之比为2:1 |
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知由此判断a、b、c、d、e依次为( )
(1)a、c均能与稀硫酸反应放出气体
(2)b与d的硝酸盐反应,置换出单质d
(3)c与强碱反应放出气体,e的一种氧化物具有磁性.
(1)a、c均能与稀硫酸反应放出气体
(2)b与d的硝酸盐反应,置换出单质d
(3)c与强碱反应放出气体,e的一种氧化物具有磁性.
| A、Fe、Cu、Al、Ag、Mg |
| B、Mg、Cu、Al、Ag、Fe |
| C、Al、Cu、Mg、Ag、Fe |
| D、Mg、Ag、Al、Cu、Fe |
下列叙述中正确的是( )
| A、凡是离子化合物在离子方程式中都要以离子来表示 |
| B、离子互换反应总是向着溶液中离子浓度减小的方向进行 |
| C、酸碱中和反应的实质是H+和OH-结合生成水,故酸碱中和反应的离子方程式都是H++OH-=H2O |
| D、复分解反应必须具备离子反应生成的三个条件才能进行 |
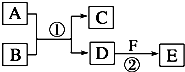 (A、B、C、D、E、F六种物质的转化关系如图(反应条件和部分产物未标出).
(A、B、C、D、E、F六种物质的转化关系如图(反应条件和部分产物未标出).