题目内容
11.标准状况下,5.6L某气态烃的质量为4g,又知该烃中碳与氢的质量比为3:1,通过计算写出该烃的分子式及结构式.分析 n=$\frac{5.6L}{22.4L/mol}$=0.25mol,M=$\frac{4g}{0.25mol}$=16g/mol,结合碳与氢的质量比为3:1计算.
解答 解:n=$\frac{5.6L}{22.4L/mol}$=0.25mol,M=$\frac{4g}{0.25mol}$=16g/mol,
又知该烃中碳与氢的质量比为3:1,则n(C):n(H)=$\frac{3}{12}$:$\frac{1}{1}$=1:4,应为甲烷,分子式为CH4,结构式为 ,
,
答:该烃的分子式为CH4,结构式为 .
.
点评 本题考查了有机物分子式的确定,侧重考查学生的分析、计算能力,难度不大,注意根据碳元素与氢元素的质量比求出该烃的实验式,结合相对分子质量确定分子式.

练习册系列答案
相关题目
12.25℃时,下列各组离子在指定溶液中一定能大量共存的( )
| A. | 在透明的溶液中:Na+、K+、MnO4-、SO42- | |
| B. | pH>7的溶液中:Fe2+、Cu2+、SO42-、Cl- | |
| C. | 有SO42-存在的溶液中:K+、Mg2+、Ag+、NO3- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- |
13.A、B、C、D四种物质之间的转化关系如图所示(部分产物略去),下列说法正确的是( )
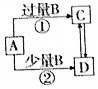

| A. | 若A为AlCl3溶液,B 可能为氨水,反应①的离子方程式为Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 若A为Fe,B可能为稀HNO3,反应②的离子方程式为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | 若A为NaOH溶液,B可能为CO2,可用Ca(OH)2溶液鉴定C、D 溶液中的阴离子 | |
| D. | 若A为Cl2,B可能为NH3,实验室可用加热固体C的方法制取NH3 |
6.一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
| A. | 7.5 L | B. | 12.3 L | C. | 15.7 L | D. | 16.8 L |
16.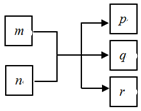 短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )| A. | 简单离子半径的大小:Y<X<Z | |
| B. | X的简单氢化物的沸点在同族元素中最高 | |
| C. | Y分别与W、Z形成的两种化合物中化学键类型相同 | |
| D. | Z的氧化物对应的水化物为强酸 |
3.下列无色气体中,遇空气变成红棕色的是( )
| A. | CO | B. | HCl | C. | SO2 | D. | NO |
1.0.5L 2mol/L FeCl3溶液与0.2L 5mol/L KCl溶液中的Cl-物质的量之比( )
| A. | 6:5 | B. | 3:2 | C. | 15:2 | D. | 3:1 |
 ,其电子所占据的电子层中,能量最高的是M层(填符号).
,其电子所占据的电子层中,能量最高的是M层(填符号).