题目内容
1.0.5L 2mol/L FeCl3溶液与0.2L 5mol/L KCl溶液中的Cl-物质的量之比( )| A. | 6:5 | B. | 3:2 | C. | 15:2 | D. | 3:1 |
分析 结合n=cV及物质的构成计算.
解答 解:0.5L 2mol/L FeCl3溶液与0.2L 5mol/L KCl溶液中的Cl-物质的量之比为0.5L×2mol/L×3:0.2L×5mol/L×1=3:1,
故选D.
点评 本题考查物质的量的计算,为高频考点,把握物质的构成、物质的量与浓度的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
12.下列各组反应中,最后得到Al(OH)3沉淀的是( )
| A. | 将Al2O3固体粉末加到沸水中 | |
| B. | 将CO2气体不断通人到NaAlO2溶液中 | |
| C. | 将过量的金属钠投入到NaAlO2溶液中 | |
| D. | 向340ml 1mol/L NaOH溶液中加入80ml 1mol/L的AlCl3溶液 |
9.在盛有溴水的试管中,加入少量苯后振荡,静置后( )
| A. | 整个溶液变橙色 | B. | 整个溶液变浅棕色 | ||
| C. | 上层无色、下层橙色 | D. | 下层无色、上层橙色 |
6. 重庆市璧山中学校在化学兴趣活动中,曾老师利用番茄做成电池(如图所示),铜片和锌片用导线连接后插入番茄里,则碳是( )
重庆市璧山中学校在化学兴趣活动中,曾老师利用番茄做成电池(如图所示),铜片和锌片用导线连接后插入番茄里,则碳是( )
 重庆市璧山中学校在化学兴趣活动中,曾老师利用番茄做成电池(如图所示),铜片和锌片用导线连接后插入番茄里,则碳是( )
重庆市璧山中学校在化学兴趣活动中,曾老师利用番茄做成电池(如图所示),铜片和锌片用导线连接后插入番茄里,则碳是( )| A. | 阳极 | B. | 正极 | C. | 阴极 | D. | 负极 |
13.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,S2和S8的固体混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 将1molFeCl3滴入足量沸水中,所分散系中粒子数目小于NA | |
| C. | 6.4g铜与硫反应时,铜失去的电子数为0.2NA | |
| D. | 标准状况下,44.8L NO与22.4L O2混合后气体中分子总数为2NA |
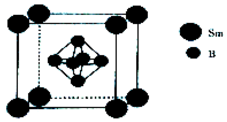 硼及其化合物在工农业生产中应用广泛.
硼及其化合物在工农业生产中应用广泛.