题目内容
8.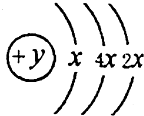 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C或B2C2,据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C或B2C2,据此填空:①A的元素名称为硅,其氧化物与氢氧化钠溶液反应的离子方程式为SiO2+2OH-=SiO32-+H2O.
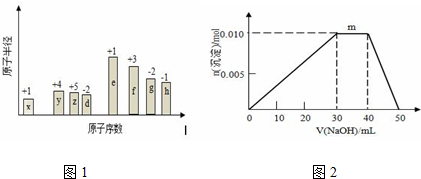
②A、B、C、D四种元素的原子半径由小到大的顺序为(用元素符号):O<S<Si<Na.
分析 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,K层最多排列2个电子,所以x=2,该原子K、L、M电子层电子数分别是2、8、4,所以y=14,为Si元素;
B、C可形成离子化合物B2C或B2C2,B化合价为+1价、C化合价可能为-1或-2,且B原子序数小于A,所以B为Na、C为O元素;
C和D同一主族且为短周期元素,所以D为S元素;
①A是Si元素;其氧化物是二氧化硅,属于酸性氧化物,能和NaOH溶液反应生成硅酸钠和水;
②原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小.
解答 解:A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,K层最多排列2个电子,所以x=2,该原子K、L、M电子层电子数分别是2、8、4,所以y=14,为Si元素;
B、C可形成离子化合物B2C或B2C2,B化合价为+1价、C化合价可能为-1或-2,且B原子序数小于A,所以B为Na、C为O元素;
C和D同一主族且为短周期元素,所以D为S元素;
①A是Si元素;其氧化物是二氧化硅,属于酸性氧化物,能和NaOH溶液反应生成硅酸钠和水,离子反应方程式为SiO2+2OH-=SiO32-+H2O,故答案为:硅;SiO2+2OH-=SiO32-+H2O;
②原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径由小到大顺序是O<S<Si<Na,故答案为:O<S<Si<Na.
点评 本题考查原子结构和元素周期律,为高频考点,明确原子结构、元素周期表结构及元素周期律是解本题关键,侧重考查学生分析判断能力,知道原子半径比较方法,题目难度不大.

| A. | 2:1:2 | B. | 5:5:4 | C. | 1:1:1 | D. | 无法确定 |
| A. | 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快 | |
| B. | 在金属钠与足量水反应中,增加水的量能加快反应速率 | |
| C. | 2SO2+O2?2SO3反应中,2molSO2在充足的氧气中不能得到2molSO3 | |
| D. | 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快 |
| A. | 能溶于水 | |
| B. | 能使紫色石蕊试液变红 | |
| C. | 能被弱碱氨水中和 | |
| D. | 常温下,0.1 mol•L-1醋酸溶液中的c(H+)为1.32×10-3mol•L-1 |
| A. | A2>B2>C2>D2 | B. | D2>C2>B2>A2 | C. | B2>C2>A2>D2 | D. | C2>A2>B2>D2 |
| A. | CH3CH2COOCH=CH2 | B. | CH3CH2COOCH2CH2CH3 | ||
| C. | CH2=CHCH2COOCH2CH2CH=CH2 | D. | CH3CH2CH2COOCH2CH(CH3)2 |