题目内容
20.能证明醋酸是弱酸的事实是( )| A. | 能溶于水 | |
| B. | 能使紫色石蕊试液变红 | |
| C. | 能被弱碱氨水中和 | |
| D. | 常温下,0.1 mol•L-1醋酸溶液中的c(H+)为1.32×10-3mol•L-1 |
分析 强弱电解质的根本区别是电离程度,完全电离的电解质是强电解质,部分电离的电解质是弱电解质,只要能说明醋酸部分电离就能证明醋酸是弱电解质,据此分析解答.
解答 解:A.电解质的溶解度大小不能确定电解质强弱,如AgCl难溶于水但AgCl是强电解质,所以不能根据醋酸能溶于水而判断醋酸是弱电解质,故A错误;
B.能使紫色石蕊试液变红色,说明醋酸电离出氢离子而使溶液呈酸性,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故B错误;
C.能被弱碱氨水中和,说明醋酸是酸,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故C错误;
D.常温下,0.1 mol•L-1醋酸溶液中的c(H+)为1.32×10-3mol•L-1,氢离子浓度小于醋酸浓度,说明醋酸部分电离,则证明醋酸是弱电解质,故D正确;
故选D.
点评 本题考查电解质强弱判断,为高频考点,明确电解质强弱根本区别是解本题关键,不能根据电解质溶解度大小及电解质溶液导电性强弱判断电解质强弱,为易错点.

练习册系列答案
相关题目
10.运用下表中的信息进行判断,得出的结论合理的是( )
| 反应 | 反应物 | 氧化产物和还原产物 |
| 反应① | Cl2、FeI2 | FeCl3、FeCl2、I2 |
| 反应② | MnO4-、Cl- | Cl2、Mn2+ |
| A. | 反应①中Cl2与 FeI2的物质的量之比为2:1 | |
| B. | 反应①中发生的离子方程式可能为:2Cl2+2Fe2++2I-→I2+2Fe3++4Cl- | |
| C. | 反应②中每生成1molCl2,电子转移数目为10mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+ |
11.如图是CO2电催化还原为CH4的工作原理示意图.下列说法正确的是( )


| A. | 该过程是化学能转化为电能的过程 | |
| B. | 一段时间后,①池中n(KHCO3)不变 | |
| C. | 一段时间后,②池中溶液的pH一定增大 | |
| D. | 铜电极的电极反应式为:CO2+6H2O+8e-═CH4+8 OH- |
15.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | CO2 | HCl | CO2 | NO2 | CO2 |
| 乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
| 丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
| A. | ②③④ | B. | ①②③④ | C. | ①③④ | D. | ②③④⑤ |
5.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 0.1mol•L-1稀硫酸中含有硫酸根个数为0.1NA | |
| B. | 7.8g过氧化钠与足量水充分反应转移电子0.1NA | |
| C. | 2.4g金属镁与足量的盐酸反应,生成氢气的体积为2.24L | |
| D. | 标准状况下,0.5NA个水分子所占体积是11.2L |
12.下列热化学方程式中正确的是( )
| A. | 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,热化学方程式是 2H2(g)+O2(g)═2H2O(l)△H=-484kJ•mol-1 | |
| B. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol | |
| C. | 1 g丙烷(C3H8)完成燃烧生成CO2气体和液态水,放出50.405 kJ热量C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2 217.82 kJ/mol | |
| D. | 1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2═SO2△H=-297.3 kJ/mol |
9.在强碱性的无色透明溶液中,可以大量共存的是( )
| A. | NH4+、Na+、NO3-、Cl- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | HCO3-、Ca2+、Na+、NO3- | D. | Cu2+、Cl-、K+、NO3- |
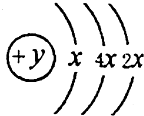 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C或B2C2,据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C或B2C2,据此填空: