题目内容
17.已知反应:①2A-+C2=2C-+A2 ②2C-+B2=2B-+C2 ③2D-+A2=2A-+D2.下列关于氧化性强弱比较正确的是( )| A. | A2>B2>C2>D2 | B. | D2>C2>B2>A2 | C. | B2>C2>A2>D2 | D. | C2>A2>B2>D2 |
分析 同一化学反应中氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,据此分析解答.
解答 解:①2A-+C2═2C-+A2 反应中氧化性C2大于A2,还原性A-大于C-;
②2C-+B2═2B-+C2 反应中氧化性B2大于C2,还原性C-大于B-;
③2D-+A2═2A-+D2反应中氧化性A2大于D2,还原性D-大于A-;
则氧化性:B2>C2>A2>D2;
故选C.
点评 本题考查了氧化性强弱比较和还原性强弱比较,题目比较基础,注意把握氧化还原反应中的一般性规律:氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 0.1mol•L-1稀硫酸中含有硫酸根个数为0.1NA | |
| B. | 7.8g过氧化钠与足量水充分反应转移电子0.1NA | |
| C. | 2.4g金属镁与足量的盐酸反应,生成氢气的体积为2.24L | |
| D. | 标准状况下,0.5NA个水分子所占体积是11.2L |
12.下列热化学方程式中正确的是( )
| A. | 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,热化学方程式是 2H2(g)+O2(g)═2H2O(l)△H=-484kJ•mol-1 | |
| B. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol | |
| C. | 1 g丙烷(C3H8)完成燃烧生成CO2气体和液态水,放出50.405 kJ热量C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2 217.82 kJ/mol | |
| D. | 1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2═SO2△H=-297.3 kJ/mol |
9.在强碱性的无色透明溶液中,可以大量共存的是( )
| A. | NH4+、Na+、NO3-、Cl- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | HCO3-、Ca2+、Na+、NO3- | D. | Cu2+、Cl-、K+、NO3- |
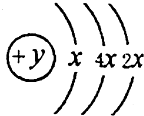 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C或B2C2,据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C或B2C2,据此填空: