题目内容
12.氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热.请你根据所学知识回答下列问题:(1)上述反应中KClO3是氧化剂,该反应中氧化产物与还原产物的物质量之比为5:1.
(2)把氯气通入紫色石蕊溶液中,可以观察到的现象是:先变红后褪色.
(3)实验室配制好2.0mol•L-1的NaOH溶液,需要这种溶液100mL才能与2.24L氯气(标准状况)恰好完全反应.
(4)已知Br2的水溶液因浓度不同而呈现橙色或红棕色,NaBr溶液中缓缓通入Cl2时,可以看到无色溶液逐渐变为红棕色,请写出对应的离子方程式并用双线桥法表示出电子转移情况:
 .
.(5)现需490mL 2.0mol•L-1 NaOH溶液:
①所需称量的氢氧化钠固体的质量是40.0g.
②上述实验需要的仪器有天平(含砝码)、药匙、烧杯、量筒、玻璃棒、胶头滴管、500 mL容量瓶.
③在配制溶液的过程中,下列操作可能造成结果偏高的是AD.
A.定容时俯视
B.容量瓶不干燥,含有少量蒸馏水
C.溶解所用烧杯未洗涤
D.NaOH溶解后,未冷却即进行实验.
分析 (1)KClO3+6HCl $\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O中,Cl元素的化合价由+5价降低为0,Cl元素的化合价由-1价升高为0,以此来解答;
(2)依据氯气和水反应生成的产物盐酸和次氯酸性质分析判断;
(3)n(Cl2)=0.1mol,根据反应的离子方程式Cl2+2OH-=CIO-+Cl-+H2O计算;
(4)氯气与溴化钠反应生成氯化钠和溴单质;
(5)①根据m=nM=cVM计算;
②根据操作的步骤确定所需仪器;
③分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使溶质的物质的量n偏大或者使溶液体积V偏小的操作,溶液浓度都偏高.
解答 解:(1)KClO3+6HCl $\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O中,1KClO3中Cl元素的化合价由+5价降低为0,则氧化剂为KClO3,5HCl中Cl元素的化合价由-1价升高为0,则还原剂为5HCl,所以氧化产物与还原产物的物质量之比为5:1,故答案为:KClO3;5:1;
(2)氯气通入紫色石蕊试液中和水反应生成盐酸使石蕊变红色,生成的次氯酸具有漂白性使红色褪去,
故答案为:先变红后褪色;
(3)n(Cl2)=0.1mol,由反应的离子方程式Cl2+2OH-=CIO-+Cl-+H2O可知n(NaOH)=0.2mol,
V(NaOH)=$\frac{0.2mol}{2mol/L}$=0.1L=100ml,
故答案为:100;
(4)氯气与溴化钠反应生成氯化钠和溴单质,对应的离子方程式并用双线桥法表示出电子转移情况: ;
;
故答案为: ;
;
(5)①现需490mL 2.0mol•L-1 NaOH溶液,则选用500ml容量瓶,所以n(NaOH)=0.5L×2mol/L=1mol,m(NaOH)=1mol×40g/mol=40.0g,
故答案为:40.0g;
②配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器有托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,则还需要500 mL容量瓶,
故答案为:500 mL容量瓶
③A.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故A选;
B.容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响,故B不选;
C.没有洗涤烧杯,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故C不选;
D.NaOH溶解后,未冷却即进行实验,导致热溶液就转移到容量瓶中,等冷却到常温体积偏小,溶液浓度偏高,故D选;
故选:AD.
点评 本题考查了氧化还原反应、氯水的性质、方程式计算以及一定物质的量浓度溶液配制过程及误差分析,准确把握操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析是解题关键,题目难度不大.

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | HCl | B. | H2SO4 | C. | 氨水 | D. | NaOH |
| A. | 皮肤上不慎沾上浓Na OH溶液,立即用稀硫酸冲洗 | |
| B. | 大量氯气泄漏时,应迅速离开现场,并尽快往高处去 | |
| C. | 不慎洒出的酒精在桌上着火时,立即用大量水扑灭 | |
| D. | 金属钠着火时,应立即用沾水的毛巾覆盖 |
| A. | 电子层 | B. | 电子层和能级 | ||
| C. | 电子层、能级和原子轨道空间分布 | D. | 原子轨道空间分布和电子自旋方向 |
| A. | 氢氧化钡中加入稀硫酸:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 次氯酸钙溶液中通入少量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| A. | CuCl2 | B. | Na2CO3 | C. | CH3COOH | D. | KHSO4 |
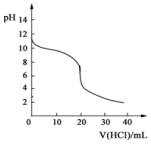 常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )| A. | 反应过程中:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| B. | V(HCl)=10.00mL时,c(NH4+)>c(Cl-)>c(NH3•H2O) | |
| C. | V(HCl)<20.00mL时,溶液一定呈碱性 | |
| D. | V(HCl)=30.00mL时,2c(Cl-)=3c(NH4+)+3c(NH3•H2O) |
| 编号 | 试剂 | 保存方法 | 理由 |
| A | 水玻璃 | 存放在带橡皮塞的细口瓶中,密封 | 防止与空气接触被氧化和与二氧化碳接触而变质 |
| B | 硫酸亚铁晶体 | 存放在带玻璃塞的广口瓶中,密封 | 防止与空气接触被氧化 |
| C | 浓硫酸 | 密闭保存 | 防止吸水和挥发 |
| D | 新制的溴水 | 存放在无色试剂瓶中,密封 | 防止挥发 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 升温 | B. | 减小气体压强 | ||
| C. | 增大反应物的浓度 | D. | 使用催化剂 |